¿Cuáles son las relaciones de proporcionalidad entre reactivos y productos?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:12
Aprendizaje esperado: r elaciona la masa de las sustancias con el mol para determinar la cantidad de sustancia.
Énfasis: identificar las relaciones de proporcionalidad entre reactivos y
¿Qué vamos aprender?
Lee la siguiente frase célebre de Thomas Henry Huxley, defensor de la teoría de la evolución de Charles Darwin: “El nacimiento de la ciencia fue la muerte de la superstición”.
En esta sesión identificarás las relaciones de proporcionalidad entre reactivos y productos en una reacción química. Lo harás con ejemplos sencillos y con materiales que tienes en casa.
¿Sabías que? Una de las formas en que los animales se comunican es por medio de sustancias químicas llamadas feromonas, las cuales tienen masas molares variables dependiendo del mensaje que van a transmitir.
Por ejemplo, las feromonas que los antílopes liberan en el aire para alertar a la manada de la presencia de un depredador tienen masas moleculares bajas, mientras que las liberadas por los conejos cuando frotan el mentón contra las piedras de la entrada de su madriguera o la reja de su jaula para marcar su territorio tienen masas moleculares altas.
Esta sesión es la primera de tres sesiones que abordarás este aprendizaje esperado. La siguiente sesión se hablará del Número de Avogadro, para finalizar con la sesión en la que se tratará el tema de cantidad de sustancia con su respectiva unidad de medida.
¿Qué hacemos?
Para comprender cuáles son las proporciones entre reactivos y productos en una reacción química, lo harás cocinando. La sección se llamará “Cocinando con química”.
Primero recuerda que los reactivos son las sustancias que mediante la ruptura y formación de nuevos enlaces participan en una reacción química, mientras que los productos son los compuestos que se forman luego de la reacción química.
Pero ten en cuenta, aunque vas a cocinar, es importante que no pierdas de vista que estarás revisando la proporcionalidad entre reactivos y productos. La cocina es una analogía que te ayudará.
De este modo puedes aprenderlo desde situaciones cotidianas, pero ¿qué vas a cocinar?
Prepararás unos deliciosos flanes.
¿Cuáles son los ingredientes? O hablando en química ¿Cuáles son los reactivos?
Los reactivos son: 4 huevos, 1 lata de leche evaporada, una lata de leche condensada y una cucharadita de vainilla y azúcar para el caramelo.
Recuerda también la ley de la conservación de la masa, la cual dice que la materia no se crea ni se destruye, solo se transforma.
En una reacción química, la suma de la masa de los reactivos es igual a la suma de la masa de los productos. Así que los ingredientes que pongas son los mismos que se convertirán en los productos. Por lo tanto, no puedo meter los flanes a hornear sin caramelo y esperar que por magia aparezcan con caramelo o que aparezca el doble de producto o la mitad.
Ahora, en la cocina ¿cuál crees que puedas considerar como la reacción química? La cocción de los ingredientes provoca un cambio en ellos, para que obtengas un producto. Así que podrías pensar en la cocción como la reacción química.
Lo que sigue es meterlos en esta estufa mágica, para que se dé la “reacción química” que convierta los reactivos en productos. Además de todas sus curiosidades, esta estufa acelera el tiempo.
Pero ¿qué pasa si quiero 3 flanes?
Pues necesitas obtener la relación de proporción entre los reactivos y los productos ¿cuánto necesitas de huevos, leche condensada y leche evaporada, de vainilla y de azúcar para obtener un flan?
Realiza la relación de proporción.
Si para un flan necesitas 4 huevos, para 2 flanes, 8 huevos, y para 3 flanes necesitas 12 huevos.
Si para un flan usas una lata de leche condensada, para 2 flanes 2 latas, para 3 flanes 3 latas. De igual forma para la leche evaporada.
¿Cuántas cucharadas de vainilla necesitarás y cuántas de azúcar?
Realiza los cálculos, apóyate en un tabulador, te será de mucha utilidad.
No pierdas el sentido de esta sesión, que es ver la relación de proporción entre reactivos y productos en una reacción química. Lo que lo hiciste es en gran medida en un sentido macroscópico. Es decir que lo puedes percibir a simple vista, y ya que tu cocina es mágica, ahora adéntrate al mundo subatómico, es decir, al nivel molecular y atómico.
Ahora, ya que usaste la cocina como analogía para conocer la importancia de las proporciones y para recordar la ley de la conservación de la masa, te centrarás en las reacciones químicas ¿qué relación consideras de una reacción química a un platillo de comida?
Lo primero, una reacción química se representa mediante una ecuación química y un platillo de cocina mediante una receta de cocina.
En toda reacción química unas sustancias llamadas reactivos se transforman en otras llamadas productos. Utiliza como analogía la ecuación química para obtener agua. Identifica ¿cuáles son los reactivos y cuáles son los productos?

Como ayuda o tip, observa cómo a manera de ecuación hiciste la receta del flan, los ingredientes equivalen a los reactivos y en este caso, el producto al flan o platillo.
Al ser los reactivos y productos sustancias diferentes, tienen propiedades distintas como color, olor, sabor, densidad, viscosidad, temperatura de fusión, entre otras.
En general, los reactivos se escriben a la izquierda y los productos a la derecha, separados por una flecha que va de reactivos a productos.
Observa las cantidades que se requieren para obtener dos moléculas de agua.
Se requieren dos moléculas de hidrógeno más una de oxígeno para obtener dos moléculas de agua.
¿Qué pasaría si requieres 4 moléculas de agua? Se cambiaría la proporción que se requieren de hidrógeno y de oxígeno, como lo hiciste con el flan. Observa:

Observa otro ejemplo. Esta es una ecuación química para obtener algo que le da sazón a la comida: la sal común, éste es su nombre por así decirlo común, pero su nombre científico es cloruro de sodio.
¿Qué reactivos necesitas? ¿cuántos átomos de cada reactivo? ¿cuánto se puede formar de sal o cloruro de sodio?
Usarás hidróxido de sodio, cuya fórmula química es NaOH, y cloruro de magnesio, de fórmula química MgCl2.
Ingresa un poco de estos reactivos a la cocina mágica e imagina qué sucede.
¿Por qué consideras que no se da esta reacción química?
Piensa en el defecto, el error, la falla. Empieza por contar los reactivos, ya que es como saber cuánto de ingredientes necesitas para obtener lo que deseas. Para el hidróxido de sodio, en papel tienes 1 átomo de sodio, uno de oxígeno y uno de hidrógeno, para el cloruro de magnesio tienes un átomo de magnesio y dos de cloro.
Detente y repite cuántos de cloruro de magnesio. Uno de magnesio y dos de cloro. Puedes darte cuenta que ahí está el error, recuerda esta ley, ya que al ser una ley siempre se debe de cumplir “la materia no se crea ni se destruye solo se transforma”.

Primero coloca la flecha. Luego, del lado izquierdo coloca los reactivos. Hidróxido de sodio el signo de más y el cloruro de magnesio. Ahora, después de la flecha, coloca el producto, es decir, el cloruro de sodio.
Para asegurarte de que se cumple la ley de la conservación de la materia, pon debajo de la flecha el listado de los elementos que participan en esta reacción química.

Sodio, magnesio, cloro, oxígeno e hidrógeno están del lado de los reactivos. En el lado de los productos está el cloro, que ya colocaste y sodio. A vista de buen químico, falta algo.
Ahora, cuenta los elementos de cada lado. Sodio 1 del lado izquierdo, del lado derecho 1.
Magnesio 1 del lado izquierdo, del lado derecho no tengo nada, es decir, colocas un cero.
Cloro es dos del lado izquierdo, del lado derecho uno.
Oxígeno 1 del lado izquierdo y del lado derecho no lo hay.
Entonces no se cumple la ley de la conservación de la materia. En los reactivos observas algunos elementos, que faltan en los productos.
Está incompleta la ecuación química, otro producto es el hidróxido de magnesio.

Ahora sí están en los reactivos, esos elementos deben aparecer en los productos. Las ecuaciones químicas sirven para representar las reacciones.
Pero no solo eso, también pueden decir muchas más cosas, pero eso lo podrás ver en sesiones posteriores.
Vuelve a contar, solo te faltan los productos: magnesio uno.
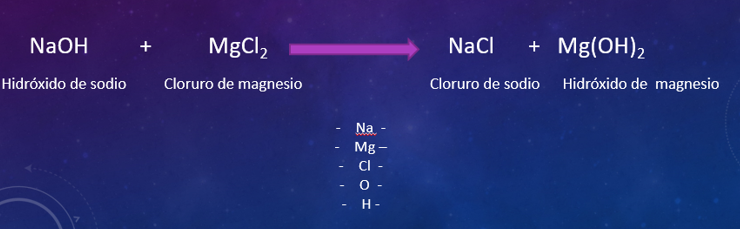
Están esos paréntesis que agrupan al hidrógeno y al oxígeno, en matemáticas ¿qué te indica?
Una multiplicación ¿por cuánto se multiplica a los de adentro? Por dos. Entonces, es uno del oxígeno, que, como ya sabes, no se coloca, por el simple hecho de estar presente en la ecuación se entiende que vale uno a menos que exista otro número como en caso del cloruro de magnesio, que el cloro tiene un dos.
Entonces es dos de afuera por uno del oxígeno, son dos. Lo mismo pasa con el hidrógeno.
Recuerda, solo multiplica a los que están dentro de los paréntesis.
Esto no está igual en reactivos y productos ¿qué harás? ¿cómo le puedes hacer para que quede balanceada la ecuación? Es decir, que lo mismo esté del lado izquierdo que del lado derecho.
En términos químicos, que en la ecuación química se cumpla, la ley de la conservación de la materia para que el número de átomos de los reactivos sea exactamente igual al de los productos.
¿Cómo le harías? Porque del lado de los reactivos tienes dos de cloro y del lado de los productos uno, del oxígeno uno y del lado de los productos dos y lo mismo pasa con el hidrógeno.
A este proceso le llamas balancear la ecuación.
Para ello, utiliza estos coeficientes, que siempre se colocarán al principio de las sustancias. Estos indican el número de átomos o moléculas de los elementos o compuestos que participan en las reacciones. También ayudan para observar y establecer en qué proporción se encuentran en la reacción los reactivos y los productos.
Los coeficientes indican la cantidad de átomos o moléculas que participa en una reacción.
Como de este lado tienes 2 átomos de cloruro, que está presente en el cloruro de magnesio, entonces del lado de los productos coloca el coeficiente. Ojo con el cuidado de que siempre se coloca al principio de las sustancias y multiplica a todos los átomos de las sustancias expresadas en la ecuación.
Entonces vuelve a hacer el conteo y queda de la siguiente manera, del lado de los reactivos. Sodio 1, cloro 2, oxígeno 1, e hidrógeno uno, y de magnesio 1.
Del lado de los productos, sodio dos, cloro dos, magnesio 1, oxígeno 2 e hidrógeno 2.
Ahora falta el hidrógeno con el oxígeno, tener dos del lado de los reactivos, anótalo en tu cuaderno.
Verifica: seguramente colocaste un 2 como coeficiente a la molécula de hidróxido de sodio, y si este dos multiplica a toda molécula, quedaría de esta forma.
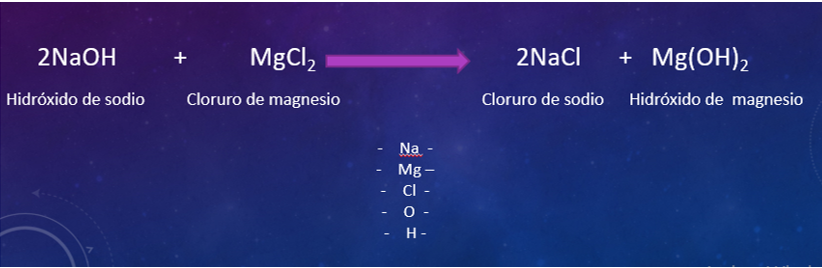
2NaOH + MgCl2 reaccionan formando 2NaCl+Mg(OH)2
Por lo tanto, requieres de 2 moléculas de hidróxido de sodio y una de cloruro de magnesio para que puedas obtener dos iones de cloruro de sodio y una molécula de hidróxido de magnesio. Ahora si se puede poner en la estufa mágica.
Funcionó a la perfección y obtienes sal e hidróxido de magnesio, que aunque no nos interesaba formarlo, se formó porque esos elementos no van a desaparecer nada más porque sí.
Realiza un ejemplo más para que quede claro.
Pero antes lee el siguiente dato curioso. Desde antes de la conquista, los pobladores de lo que hoy la Ciudad de México sabían de la existencia y el aprovechamiento de las sales alcalinas.
En el tiempo de sequía, estas sales afloraban a la superficie formando costras, que recibieron el nombre de tequisquitl o tequesquite.
El lago de Texcoco contiene 81% de sales, entre las que sobresalen, el carbonato de sodio, Na2CO3, con 45% el cloruro de sodio NaCl con 34 %.
Al añadir el tequesquite a la comida se condimentaba con sal y se facilitaba la cocción de legumbres. También se le empleaba como detergente alcalinizante ligero.
Observa cómo en presencia del oxígeno presente en la atmósfera se permite la combustión, y que, al agotarse, se detiene la reacción química.
Cuenta en la siguiente lista:
1 átomo de carbono en reactivos y 1 en productos.
4 átomos de hidrógeno en reactivos y 2 en productos, por último,
2 átomos de oxígeno en reactivos y 3 en productos.
Evidentemente no cumple con la ley de la conservación de la materia, para que se dé la reacción química es necesario utilizar los coeficientes y ver en qué proporción serán necesarios.
¿En dónde colocaste los coeficientes? El primero lo colocaste en el oxígeno molecular del lado de los reactivos.
Colocaste en el lado de los productos el coeficiente 2, en la molécula de agua. Quedando así una correcta relación de proporcionalidad entre reactivos y productos en la ecuación.
La cual se puede leer así:

Una molécula de metano reacciona en presencia de 2 moléculas de oxígeno, produciendo la combustión de gas metano y obteniendo como producto:
2 moléculas de agua y desprendiéndose una molécula de dióxido de carbono.
Ahora comprueba si funciona tu estufa mágica.
Revisa otra situación de la vida real, experimenta con la reacción química de la descomposición del agua.
Los materiales que vas a necesitar son los siguientes:
Agua oxigenada al 30 %, se te recomienda que extremes precauciones ya que si entra en contacto con la piel no será muy agradable, recuerda también que requieren la supervisión de un adulto si lo quieren hacer en casa, si por alguna situación les cayera agua oxigenada en la piel, enjuaguen con abundante agua a temperatura ambiente.
Yoduro de potasio, el cual va a actuar como un catalizador, es decir, va a acelerar la reacción que observarás.
Introduce 30 ml de agua oxigenada en un recipiente de cristal. Agrega 1 o 2 gramos de yoduro de potasio. Y observa a cierta distancia como medida precautoria.
Poco a poco la reacción se va volviendo cada vez más rápida, incluso violenta, desprendiéndose el oxígeno del agua oxigenada.
Cómo pudiste darte cuenta, observaste en vivo y a todo color una reacción química, ahora expresa en una ecuación química.
Tienes peróxido de hidrógeno, que de modo común se llama agua oxigenada, que reacciona en presencia de yoduro de potasio, que es un catalizador acelerando la reacción. La ecuación química es:

El peróxido de hidrógeno H2O2 se descompone en agua desprendiendo oxígeno molecular.
Otra vez, no está en las proporciones correctas y no cumple con la ley de la conservación de la materia.
Nuevamente haces tú listado. Aquí solo tienes dos elementos, el oxígeno e hidrógeno. Haciendo el cálculo de cuántos hay de cada uno. 2 átomos de hidrógeno del lado de los reactivos y dos de los productos.
Ése está balanceado, sin embargo, los átomos de oxígeno no se encuentran en la misma cantidad o en su correcta proporción ya que hay dos átomos del lado de los reactivos y tres del lado de los productos.
Seguramente colocaste ya un coeficiente 2 de moléculas de agua.
Entonces queda lo siguiente: cuatro átomos de hidrógeno en reactivos y dos en productos, 4 átomos de oxígeno en reactivos y 3 en productos.
También pusiste un coeficiente 2 en el agua oxigenada y un coeficiente 2 en el agua.
Entonces ya está correcto y la proporción queda de la siguiente manera:

2 moléculas de peróxido de hidrógeno (agua oxigenada), se descomponen y dan 2 moléculas de agua y liberándose una molécula de oxígeno.
Recuerda la ley de la conservación de la materia. La materia no se crea ni se destruye solo se transforma.
El reto de hoy:
Elabora varios ejemplos donde puedas abordar la proporción de los reactivos con los productos en una reacción química, por medio de una tabla, de ser posible utiliza modelos como esferas, cubos o cualquier material que tu imaginación te permita.
Además de ello, utiliza la tabla periódica y el libro de texto.
La lectura es un mundo que nos permite dejar volar la imaginación, conocer, comprender, y porque no, adentrarte en un personaje y percibir desde otro punto de vista la realidad.
Se te recomienda el libro de Stephen Hawking: su vida, sus teorías y su influencia, donde podrás conocer sobre la vida de uno de los científicos más grandes de nuestra época.
Lo podrás encontrar en la Biblioteca Escolar de la colección de los Libros del Rincón.
¡Buen trabajo!
Gracias por tu esfuerzo.
Para saber más:
Lecturas
https://www.conaliteg.sep.gob.mx/secundaria.html



Login to join the discussion