¿Qué cambia y qué permanece en las reacciones químicas
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:11Aprendizaje esperado: identifica las propiedades de los reactivos y los productos en una reacción química.
Énfasis: d escribir las propiedades de reactivos y productos a fin de explicar qué cambia y qué permanece en las reacciones químicas.
¿Qué vamos a prender?
Lee la siguiente frase célebre: “La educación es el pasaporte hacia el futuro, el mañana pertenece a aquellos que se preparan para él en el día de hoy” Malcolm X, activista afroamericano.
El propósito de esta sesión es que, a partir de la observación y la experimentación, describas las propiedades de reactivos y productos, a fin de explicar qué cambia y qué permanece en las reacciones químicas.
Realizarás actividades experimentales en las cuales tendrás que registrar tus observaciones en las tablas correspondientes.
¿Sabías qué…? El amor es un proceso que se da en el cerebro y no en el corazón. Ese sentimiento se origina en una zona llamada circuito de recompensa, ubicado debajo de la corteza cerebral e involucra biomoléculas relacionadas con las emociones como: la dopamina, serotonina, noradrenalina, endorfinas, feniletilamina, adrenalina, entre otras.
Así que el responsable de ese calor, nerviosismo, tartamudeo, mariposas en el estómago y la aceleración de los latidos del corazón que sientes cuando ves a la persona amada, no es cupido, es la Química del amor.
Ten a la mano tu libreta, tu libro de texto, masa moldeable o plastilina.
¿Qué hacemos?
Desde el inicio de los tiempos el ser humano adquirió la habilidad de modificar su entorno creando medicinas, preparando sus alimentos, elaborando herramientas, cerámica, y creando procesos como el teñido de fibras vegetales, entre otros. Lo anterior le dio la posibilidad de modificar la materia.
Recuerda que materia es todo lo que ocupa un lugar en el espacio y tiene masa. A lo largo de la vida observas y experimentas cambios constantemente.
Cuando fríes un huevo, por ejemplo, el color, la textura y hasta el tamaño, cambian durante la cocción. En casos como éste no hay manera de que el cambio sea reversible, es decir, el huevo no puede volver a tener las propiedades que tenía cuando estaba crudo.
Sin embargo, si calientas agua hasta ebullición por un rato, verás cómo en poco tiempo se transforma en vapor. ¿Qué pasa si tapas esa agua en ebullición?
Si cubres la sartén con una tapa el agua seguirá en la sartén ¿por qué no se evapora totalmente? En esta situación observas que el agua, aunque sí se evapora, al llegar a la tapa en estado gaseoso, se condensa y cae a la sartén.
Si en ambos casos, tanto el huevo como el agua se sometieron a la acción del calor, la diferencia radica en el “nivel” en el que se da el cambio, pero también en las propiedades de la materia que conforma tanto al agua como al huevo.
Los cambios que presentan los materiales pueden ser de dos tipos: físicos y químicos.
En Ciencias II conociste varios cambios físicos, como la deformación de un cuerpo por la acción de una fuerza o los cambios de estado. En estos cambios no se altera la estructura interna de la materia, es decir no se altera la configuración de átomos y moléculas.
Los cambios que se dan en las sustancias originales, para transformarse en otras distintas, se conocen como cambios químicos.
Recuerda que la Química es la ciencia que estudia a la materia, sus propiedades, estructura, composición, sus transformaciones, así como la energía involucrada en ellas.
Algunas reacciones químicas presentan manifestaciones que pueden ser perceptibles a simple vista, por ejemplo:
- Cambio de color
- Desprendimiento de un gas
- Formación de una sustancia sólida (precipitado)
- Emisión de luz, chispas o fuego
- Emisión de calor
Pero debes tener cuidado, pues no siempre estas manifestaciones son señales de que hubo una reacción química.
Por ejemplo, cuando enciendes un foco se produce calor y luz, pero no ocurre ningún cambio dentro del foco. Otro ejemplo es lo que le ocurre a la sal que es blanca, pero cuando se disuelve en el agua la disolución es transparente.
Pero entonces:
- ¿Cómo saber que hubo un cambio químico verdadero?
- ¿Qué cambia y qué permanece en las reacciones químicas?
- ¿Qué sucede con las propiedades de las sustancias iniciales?
- ¿Son iguales a las propiedades de las sustancias finales?
Realiza el siguiente ejercicio, en tu libreta escribe estas preguntas y al final de la sesión podrás darles respuesta.
Además, toma nota de los aspectos que te parezcan más interesantes, para poderlos compartir con tus compañeros o con tus profesores.
Lee el siguiente dato curioso:
La celulosa es un polisacárido que da estructura a las plantas formando tejidos de sostén como las paredes celulares de células vegetales. Fue descubierta y aislada de materia vegetal en 1838 y es la biomolécula más abundante ya que forma parte de la biomasa terrestre.
Enzimas específicas pueden degradar a la celulosa para ser convertida a moléculas más pequeñas que pueden ser aprovechadas como fuente de energía y estructural. La mayoría de los animales, incluyendo al hombre, carecen de estas enzimas.
Para dar respuesta a las preguntas planteadas anteriormente observa. Las sustancias que inician una reacción química son comúnmente llamadas reactivos, mientras que las sustancias que se forman al finalizar la reacción, se llaman productos.
Al ser los reactivos y los productos sustancias distintas, las propiedades de ambos también lo son.
Por ejemplo, al preparar un pastel las características de la harina, la mantequilla, la leche, el polvo para hornear y del huevo son muy diferentes a las del pastel ya terminado. Las propiedades de esta mezcla que se forma (la masa) cambian tanto después de ser horneada que son evidentes para los ojos, y claro, para el estómago.
Otro aspecto a considerar es que una reacción química, es un proceso en donde se rompen enlaces de los reactivos y se forman nuevos enlaces en los productos.
Si te es posible, realizarás cinco diferentes actividades experimentales las cuales tendrás que identificar:
- ¿Cuáles son los reactivos?
- Con la ayuda de la tabla periódica escribe los nombres de los elementos involucrados.
- El o los productos formados.
- Propiedades físicas de reactivos y productos.
- Manifestación visible del cambio químico que ocurrió.
Esto lo realizarás completando las tablas en cada actividad experimental.
Actividad experimental 1
Necesitas:
- Limadura de hierro
- Azufre
- Cucharilla de combustión
- Lámpara de alcohol
- Imán
1. Observa las propiedades físicas de las sustancias iniciales como el color, estado de agregación, densidad, propiedades magnéticas. Regístralas en la siguiente tabla:
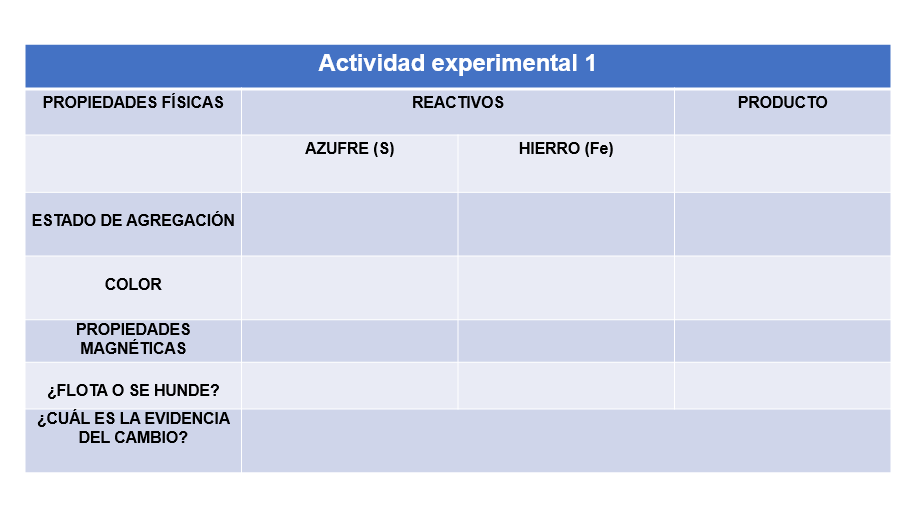
Para la densidad, colocas un poco de cada una de las sustancias iniciales en los tubos de ensayo y adiciona 5 ml de agua ¿qué observas? ¿flota o se hunde? ¿son más o menos densos que el agua?
Para determinar si tienen propiedades magnéticas acerca un imán a cada uno de los reactivos ¿qué observas?
Una vez que has analizado sus propiedades físicas procede:
2. Mezcla la punta de una cuchara de la limadura de hierro y la misma cantidad de azufre en el vidrio de reloj y coloca en la cucharilla de combustión, calienta con la lámpara de alcohol.
3. Observa el producto formado ¿se parece a las sustancias iniciales? ¿tiene propiedades magnéticas? ¿flota o se hunde? ¿cuál es el compuesto obtenido?
Resuelve esta última pregunta.
Tienes un átomo de hierro que se unió a un átomo de azufre, formando un compuesto llamado sulfuro de hierro (II) en este proceso se formó un nuevo enlace entre el hierro y el azufre ¿qué tipo de enlace se formó? Recuerdas metal y no metal: enlace iónico.
(Representación con modelos hechos con masa).
La nueva sustancia formada se llama sulfuro de hierro y está constituida por un átomo de hierro y un átomo de azufre y cómo pudiste observar, las propiedades del producto formado son completamente distintas a las de los reactivos o sustancias iniciales.
Actividad experimental 2
Necesitas:
Vinagre y bicarbonato de sodio
Antes de comenzar observa el estado físico y la apariencia de los reactivos, regístralos en la tabla.
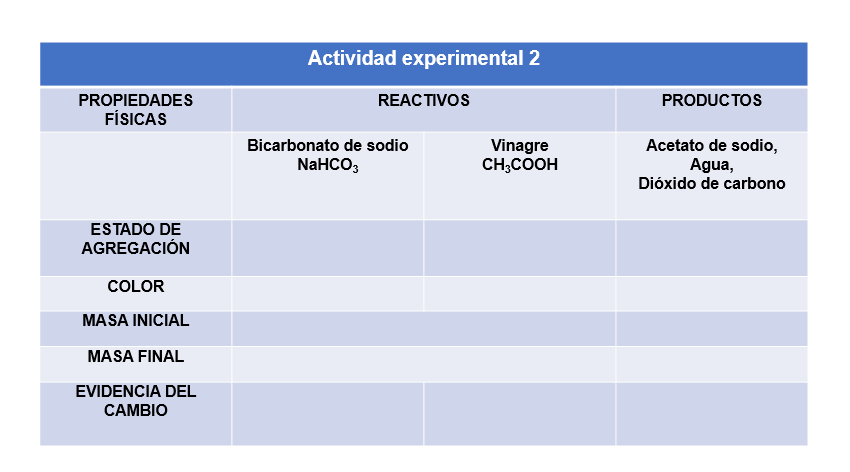
Ahora coloca en un matraz Erlenmeyer 100 mL de vinagre. En un globo coloca media cucharada de bicarbonato de sodio.
Pesa las sustancias iniciales, registra la masa en la tabla correspondiente.
Coloca el globo en la boca del matraz y lo levantas, observa con mucha atención. Una vez terminada la reacción vuelve a pesar ¿cómo son las masas antes y después de la reacción? ¿qué cambió? ¿qué se conservó?
Como observaste las propiedades físicas de los reactivos cambiaron, pero hay algo que se conservó.
¿Qué es? La masa.
La Ley de la conservación de la materia enunciada por Lavoisier, que dice que en un sistema cerrado cuando se produce una reacción química, las masas no cambian. Es decir “las masas de los reactivos son iguales a las masas de los productos”.
No olvides registrar en la tabla cual fue la manifestación de cambio químico que observaste.
Actividad experimental 3
Las sustancias iniciales en este caso son el ácido clorhídrico y una granalla de zinc. Observa los estados de agregación de los reactivos, su apariencia física y registra en la tabla.

Mide la temperatura inicial del ácido clorhídrico y del zinc con la ayuda del termómetro, regístrala nuevamente.
A continuación, en un tubo de ensayo coloca la granalla de zinc y adiciona con mucha precaución 5 ml de ácido clorhídrico.
Observa atentamente, ¿qué sucede?
Mide ahora la temperatura de la reacción, regístrala en la tabla. ¿qué cambió? ¿qué pasó con las temperaturas? ¿cuál es el estado físico de los productos formados? ¿cuál es la manifestación de que ocurrió un cambio químico?
Actividad experimental 4
Todos han utilizado en alguna ocasión el peróxido de hidrógeno, también conocido como agua oxigenada; donde el agua oxigenada es agua, pero con más átomos de oxígeno, observa cómo está constituida su molécula.
Esta sustancia es inestable, es decir, que se descompone en agua y oxígeno, también es muy corrosiva, por lo que no se puede guardar en recipientes de vidrio, pero si en botellas de plástico, pero de color oscuro, para evitar que se descomponga por la acción de la luz. Observa en esta actividad experimental cómo puedes acelerar la descomposición del agua oxigenada en agua y oxígeno, para eso vas a utilizar una sustancia presente en las pilas o baterías, que es el dióxido de manganeso.
Necesitas:
Agua oxigenada comercial y concentrada (110 volúmenes) y dióxido de manganeso que se extrajo previamente de una pila y una varita de madera.
Observa las propiedades físicas de las sustancias iniciales y regístralas en la tabla correspondiente.
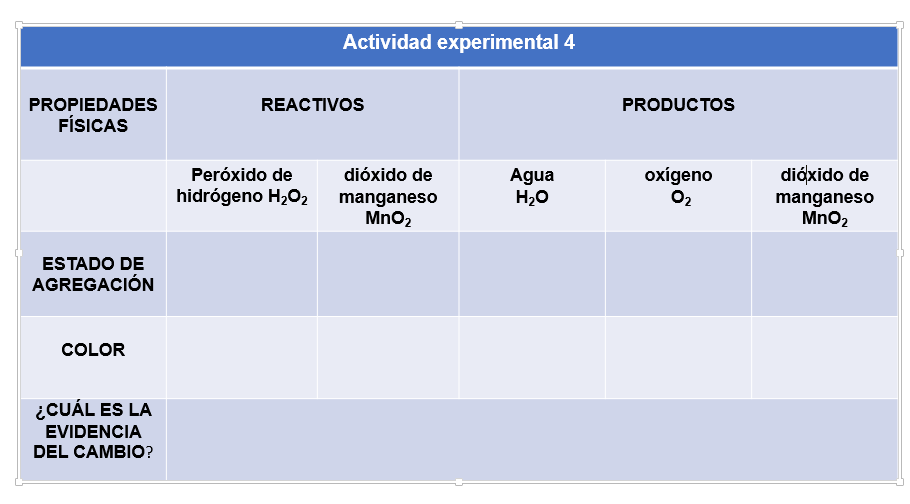
Coloca en el matraz Erlenmeyer un poco de dióxido de manganeso y agrega aproximadamente 30 mL de agua oxigenada.
Para acelerar la reacción agrega agua oxigenada concentrada. Observa cómo la reacción se lleva a cabo más rápidamente, el gas que se despende es oxígeno. ¿Cómo lo puedes comprobar?
Enciende una varita de madera, la apagas y la introduces en el matraz, observa cómo se enciende nuevamente por la acción del oxígeno.
Anota el estado de agregación de los productos formados, entonces, ¿por qué el dióxido de manganeso aparece en la tabla en reactivos y en productos?
Esto es porque el dióxido de manganeso solo “ayuda” a que la reacción química suceda más rápido, pero no se transforma, a estas sustancias se les conoce como “catalizadores”. Estos, aceleran una reacción sin formar parte de la misma.
¿Qué sucedió con el agua oxigenada? Explícalo utilizando los modelos. En esta reacción química los enlaces del agua oxigenada se rompen y se forman nuevos enlaces en el agua y la molécula de oxígeno.
Para la última actividad experimental. Necesitas:
Un clavo de hierro y sulfato de cobre en disolución acuosa.
Observa las propiedades de los reactivos, color y estado de agregación. Realiza las anotaciones correspondientes en la tabla.

Ahora coloca el clavo dentro de un tubo de ensayo y agrega la disolución de sulfato de cobre. Observa lo que sucede.
El estado de agregación de los productos y la coloración obtenida, el clavo desapareció y se convirtió en cobre.
Químicamente hablando no desapareció, sólo se transformó.
Una vez más se rompieron enlaces. El enlace del cobre con el sulfato de cobre se rompió y se formó un nuevo enlace entre el anión sulfato y el hierro, por lo que el cobre queda libre por eso su aparición en el fondo del tubo de ensayo.
Para que una reacción química ocurra es necesario que se presenten estos sucesos:
- Choques o colisiones entre los átomos de los reactivos.
- Ruptura de enlaces de los átomos de los reactivos.
- Producción de nuevas sustancias con enlaces diferentes entre los átomos que las forman.
¿Recuerdas las preguntas iniciales? ¿qué cambia y qué permanece en las reacciones químicas?
Con lo que has aprendido ya puedes dar respuesta, cambian las propiedades de los reactivos y los productos, se rompen y se forman nuevos enlaces. En todos los casos se conserva la masa, también los átomos se conservan con un reacomodo, para formar sustancias nuevas, los productos de la reacción.
Las reacciones químicas están presentes en muchos aspectos de la vida, la mayoría de las veces sin necesitar de tu participación. Sin embargo, muchas reacciones químicas ayudan, gracias a ellas se han elaborado nuevos materiales y productos como los medicamentos. En la síntesis de fármacos se parte de algunos reactivos muy bien conocidos y en condiciones bien controladas para permitir la formación de un producto con propiedades químicas particulares empleadas para una finalidad específica, tal es el caso de los anticonceptivos orales.
La síntesis de la noretisterona por primera vez, llevó a la producción del primer anticonceptivo oral. Este es uno de los 60 inventos más importantes que revolucionaron al mundo, la mayor contribución de la ciencia mexicana en toda su historia y el hallazgo científico de un joven estudiante de química de la UNAM: Luis Ernesto Miramontes Cárdenas. Su aportación a la humanidad es tan grande como la de cualquier Premio Nobel.
Miramontes Cárdenas tenía 26 años de edad cuando encontró la primera ruta para sintetizar la noretisterona. Ya no se tendría que extraer de una planta, con un costo muy elevado, sino que a partir de ese momento se podía sintetizar en laboratorio.
El Reto de Hoy:
Para seguir aprendiendo más sobre las reacciones químicas te recomendamos el libro “La Química y la cocina ” Autor: Jo sé Luis Córdova Frunz , 3ª. Edición. México Fondo de Cultura Económica disponible en la siguiente página electrónica:
http://bibliotecadigital.ilce.edu.mx/sites/ciencia/volumen2/ciencia3/093/html/laquimic.html
En la siguiente sesión aprenderás más sobre representar el cambio químico mediante una ecuación e interpretar la información que contiene.
¡Buen trabajo!
Gracias por tu esfuerzo.
Lecturas
https://www.conaliteg.sep.gob.mx/secundaria.html


Login to join the discussion