¿Cuáles son las manifestaciones de los cambios químicos?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:12
¿Cuáles son las manifestaciones de los cambios químicos?
Aprendizaje esperado: describe algunas manifestaciones de cambios químicos sencillos (efervescencia, emisión de luz o calor, precipitación, cambio de color).
Énfasis: identificar y describir algunas manifestaciones de cambios químicos sencillos (efervescencia, emisión de luz o calor, precipitación, cambio de color) por medio de actividades experimentales.
¿Qué vamos a aprender?
Lee la siguiente frase de Thomas Henry Huxley: “El nacimiento de la ciencia fue la muerte de la superstición”.
Se presentarán algunas reacciones con manifestaciones como efervescencia, emisión de luz o calor, precipitación o cambio de color. Estas reacciones se van a representar por medio de modelos atómicos y simbología química.
Para esta sesión necesitarán tu cuaderno, tu libro de texto de Ciencias III, la Tabla periódica de los elementos químicos, lápiz, colores y bolígrafo.
Recuerda anotar en tu cuaderno tus dudas. También puedes consultar tu libro de texto o preguntarle a tu profesora o profesor para nutrir tu aprendizaje.
¿Qué hacemos?
Recuerda que vives rodeado de cambios químicos. Identifica algunos.
Por ejemplo: seguramente en tu casa han organizado una carne asada.
¿Qué necesitas?
Lo primero es prender el carbón. Si aplicas aire con un cartón o con una secadora de cabello se aumenta la concentración de oxígeno; de esta manera se encenderá con más rapidez el carbón. Si dejas que el carbón encienda solo, demorará más tiempo en estar listo para comenzar a cocinar el asado.
¿Qué manifestaciones de cambios químicos se observan?
Durante esta reacción observas un cambio de color, desprendimiento de un gas y emisión de luz y calor.
Después del asado ¿Habrá postre? Por ejemplo, un panqué.
Una vez que ya están todos los ingredientes del panqué integrados, debes meterlos al horno entre los 150° y 200° Celsius y estará listo en unos 40 minutos. Sin embargo, si lo dejas a temperatura ambiente, jamás estará listo ¿A qué se debe esto?
La reacción de Maillard es el conjunto de reacciones químicas producidas entre las proteínas y los azúcares de los alimentos al ser sometidas a altas temperaturas. Gracias a ésta, el pan adquirirá su color, sabor y olor característicos. Este conjunto de reacciones también son las responsables del cambio de color observados en muchos alimentos al cocinarlos, como es el caso de la carne asada.
Casi todo lo que se encuentra a tu alrededor y que utilizas de manera cotidiana, se obtiene mediante las reacciones químicas. Aunque es fácil observar estos cambios en algunas reacciones, existen algunas en las que no es evidente algún tipo de manifestación.
¿Sabías qué? Cuando tapas la sartén en la que estas rehogando cebolla a fuego muy lento y con un poco de mantequilla o aceite, el calor evapora parte del agua interior de las células de la cebolla y la presión del vapor las revienta y libera sus jugos, hasta que la cebolla se ablanda y se vuelve traslúcida. Si mantienes la sartén destapada, los jugos desprendidos por las células de la cebolla se evaporarán más rápido y la temperatura aumentará hasta desencadenar las reacciones de Maillard; así la cebolla quedará blanda y de color caramelo, con un sabor dulce y suave.
Los cambios químicos, denominados reacciones químicas, implican la transformación de la estructura de las sustancias. Aunque, no siempre se puede observar este cambio a simple vista.
Estos cambios son muy importantes en la vida.
¿Cómo sabes cuándo se están llevando a cabo?
Algunos de los cambios químicos se manifiestan de forma sencilla, lo que permite percibirlos. Ejemplo de ello son manifestaciones como la efervescencia y la precipitación.
La efervescencia consiste en la producción de un gas en un líquido como resultado de una reacción química.
Observa una reacción química donde se manifiesta este cambio:
Ácido cítrico en contacto con bicarbonato de sodio da lugar a una sal, el citrato de sodio monobásico, agua y un gas, el dióxido de carbono.
Entonces, las reacciones de efervescencia son aquellas en donde hay desprendimiento o formación de un gas, en este caso, dióxido de carbono.

¿Distingues eso en la ecuación?
¿Notas las letras minúsculas entre paréntesis colocadas al lado de las sustancias?
Éstas indican el estado físico de los reactivos y los productos; (g) señala que se trata de un gas; (ac), que es una disolución acuosa; el estado líquido se representa con una ele minúscula, como se observa en el agua (l).
Para observar la efervescencia en una reacción química, elabora bombas de baño efervescentes que se pueden utilizar para manos o pies. Estos productos se pueden encontrar comercialmente, ya que presentan propiedades hidratantes, producen un efecto relajante y desinflamante, así como nutrimentos para la piel.
¿Qué necesitas?
- Bicarbonato de sodio.
- Ácido cítrico.
- Un recipiente hondo de vidrio.
- Taza medidora.
- Un limón o naranja.
- Aceite de almendras.
- Esencia de naranja, o bien flores con olor intenso y durable, como lavanda, menta o yerbabuena.
- Colorante vegetal.
Dentro del recipiente hondo colocas una taza rasa de bicarbonato de sodio puro y ¾ de taza de ácido cítrico en polvo -esta sustancia es fácil de conseguir en locales de materia prima- y mezclas de forma homogénea.
En un recipiente extra preparas un poco de ralladura de cáscara de naranja o limón, o bien, puedes utilizar las flores con olor penetrante, dos cucharas cafeteras de aceite de almendras, dos del colorante de su preferencia y mezclamos de forma homogénea.
Integras la mezcla líquida a la mezcla de bicarbonato de sodio con ácido cítrico y con las manos revuelves hasta obtener una pasta moldeable.
Con dicha pasta, elaboras esferas y las compactas para que no se rompan o agrieten, se deben dejar secar y endurecer para así poder hacer uso de ellas. Este proceso tarda 24 horas aproximadamente.
Si deseas realizar alguna figura puedes utilizar cortadores de galleta y también comprimir dentro de este, hasta que el molde salga sin problema.
Para que se lleve a cabo la efervescencia y entender cómo se produce y por qué, en una bandeja amplia, colocas agua tibia y una de las esferas o figuras que realizaste.
La temperatura del agua solo acelerará la reacción.
De inmediato notarás que la esfera, conformada en su mayor parte por ácido cítrico y bicarbonato de sodio, al contacto con el agua, reacciona de forma burbujeante, llevando a cabo la reacción que estudiaste anteriormente, dando como productos citrato de sodio monobásico, agua y dióxido de carbono CO2, que es el que se libera en forma de gas, dando lugar a las burbujas que percibes. Por ello, la consideras como una reacción de efervescencia.
¿En qué otros aspectos cotidianos visualizas las reacciones de efervescencia?
La efervescencia suele emplearse para enmascarar el sabor salado o amargo de algunas medicinas como la aspirina o el ácido ascórbico (vitamina c), así como también en algunas bebidas alcohólicas como los vinos espumosos o el champagne, en éstos, la reacción se activa con la saliva y genera un divertido cosquilleo.
Consulta la siguiente liga para que sigas ampliando tu conocimiento:
Ahora conoce las reacciones de precipitación.
Éstas se producen cuando, al reaccionar una sustancia con otra que está presente en una disolución acuosa, se forma un sólido al que se le denomina precipitado, debido a que, en la mayoría de los casos, el sólido formado se deposita en el fondo del recipiente donde esté contenida.
Por ejemplo, el aluminio se obtiene por precipitación: Una vez que se han eliminado las impurezas del mineral llamado bauxita -un mineral de color rojizo- al extraer el polvo de la bauxita, éste se humedece para formar una masa que se disuelve con hidróxido de sodio, conocido comúnmente como sosa cáustica, proceso que se lleva a cabo a alta presión.
La mezcla se filtra y se enfría para formar cristales, los cuales se calientan a 1000°Celsius y el resultado es un polvo blanco brillante muy similar al azúcar, cuyo componente es el óxido de aluminio, o alúmina, del cual se puede obtener el aluminio metálico.
En estas reacciones intervienen principalmente compuestos iónicos, es decir, que los iones existentes en el medio pueden reaccionar entre ellos formando una sustancia insoluble, que denominas precipitado.
Esta actividad experimental es demostrativa.
¿Qué necesitas?
- Agua destilada.
- Taza medidora.
- Vasos de vidrio.
- Hidróxido de Sodio (Sosa Cáustica).
- Sulfato de cobre y sulfato de hierro, que podrás conseguir en alguna tienda de jardinería.
Si quieres replicar esta actividad experimental es importante que la realices bajo la supervisión de un adulto y con las medidas de seguridad recomendadas.
Revisa las especificaciones de los reactivos, por ejemplo, la sosa caustica es una sustancia altamente irritante, y el sulfato de cobre puede causar irritación en ojos y piel.
Lo harás con apoyo de la taza medidora, coloca 100 mL de agua destilada en cada uno de los vasos de vidrio.
Posteriormente, en uno de ellos, coloca una cucharada cafetera de hidróxido de sodio y disuelve.
Ahora, en el vaso que resta, coloca una cucharada de sulfato de cobre. Agita hasta disolver.
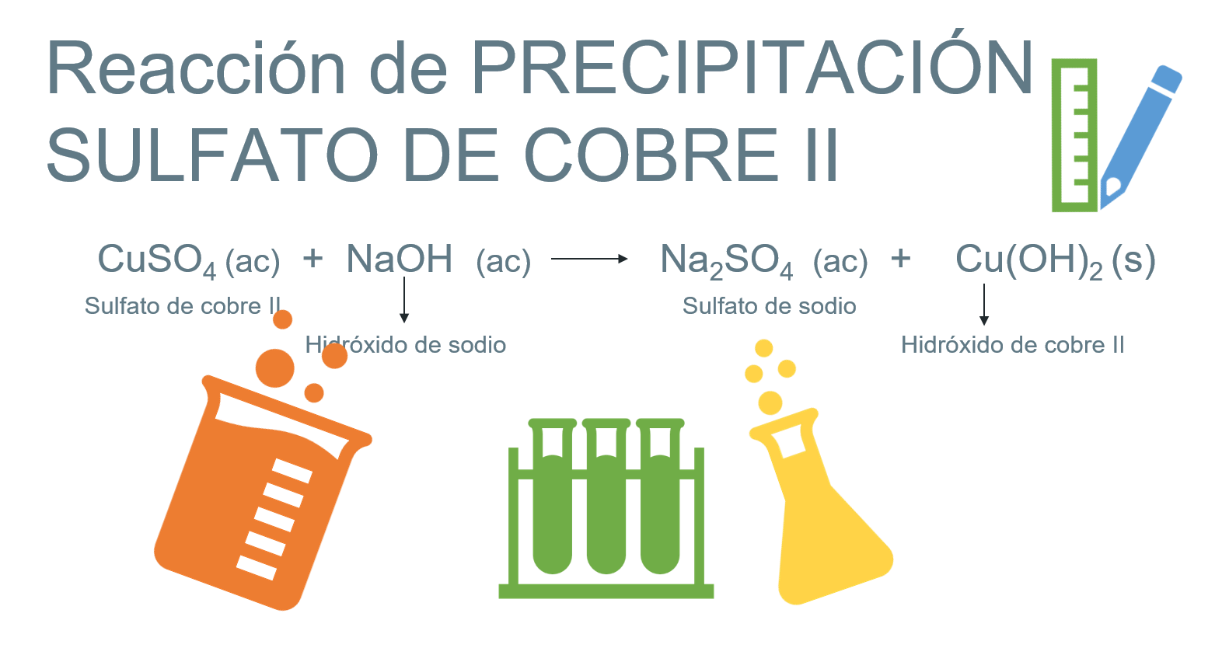
Posteriormente, toma la disolución de hidróxido de sodio y coloca solo un poco en la disolución de sulfato de cobre. Si tienes un gotero puedes utilizarlo para adicionar poco a poco la disolución de hidróxido de sodio al vaso que contiene la disolución de sulfato de cobre.
Se está formando un compuesto insoluble.
La reacción entre el hidróxido de sodio al contacto con el sulfato de cobre (II), produce la formación de un precipitado de hidróxido de cobre (II), además de la formación de sulfato de sodio.
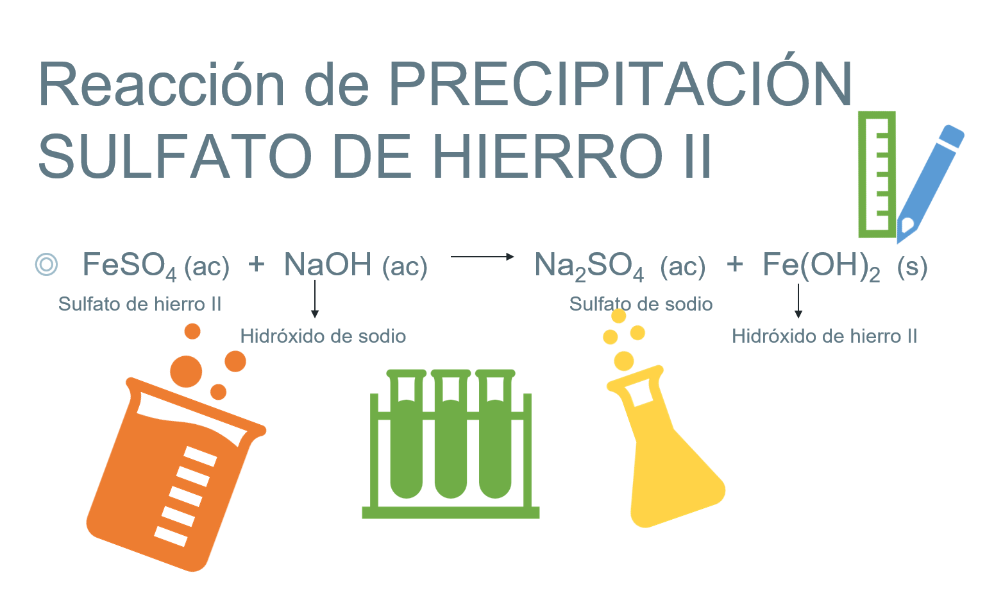
También podrás observar una reacción de precipitación si realizas la actividad experimental con sulfato de hierro II y el hidróxido de sodio.
El procedimiento es el mismo:
En un tercer vaso coloca 100 mL de agua destilada y una cucharada de sulfato de hierro. Agrega a esta disolución un poco de disolución de hidróxido de sodio.
Al instante tienes un precipitado rojizo, originado por el contacto de sulfato de hierro (II) e hidróxido de sodio que da lugar a la formación de sulfato de sodio, soluble en agua, e hidróxido de hierro (II) que corresponde al compuesto insoluble.
El precipitado de hidróxido de cobre II suele utilizarse para tratar madera y así alargar su vida útil, también se utiliza como fungicida y bactericida en la industria agrícola.
En cambio, el precipitado de hidróxido de hierro II suele indicarse a adultos mayores para tratar déficit de hierro en la sangre; o bien como antídoto para el arsénico.
Las reacciones de precipitación ocurren en la naturaleza. Dentro de las maravillas naturales se encuentran las estalactitas y las estalagmitas ¿Alguna vez han visto una?

Su formación depende de una reacción química reversible, donde el carbonato de calcio, en forma de piedra caliza, se encuentra en depósitos subterráneos.
Cuando el agua se filtra a través de la roca, lleva dióxido de carbono disuelto y ocurre la siguiente reacción:
Carbonato de calcio en contacto con dióxido de carbono y agua da lugar a un ion de calcio y un ion de bicarbonato.
Cuando el agua mineralizada llega a la gruta, ocurre la reacción inversa, la de precipitación. En este caso se desprende el dióxido de carbono y se deposita el carbonato de calcio sólido.
Representado por:
Ion de calcio en contacto con ion de bicarbonato, da lugar a carbonato de calcio, dióxido de carbono y agua.
Son estos depósitos de carbonato de calcio los que le dan forma a las estalactitas y estalagmitas.
Cada año se registran 16, 000 000 de tormentas con rayos. Durante estas tormentas eléctricas, el oxígeno y el nitrógeno en el aire interaccionan químicamente para formar óxido de nitrógeno II, uno de los gases presentes en dichos relámpagos.
N2(g) + O2(g) 2NO(g)
La frecuencia de los rayos es de aproximadamente 44 (± 5) veces por segundo, o casi 1400 millones de destellos por año, siendo la duración media de 0.2 segundos.
El mundo está en constante transformación: La oxidación de los metales; el nacimiento, crecimiento, reproducción y muerte de plantas y animales; los alimentos que ingieres –que se transforman dentro de tu cuerpo- o los alimentos que al estar a la intemperie se descomponen, por mencionar sólo algunos, son ejemplos de cambios químicos.
La química se encarga de estudiar los cambios químicos aun cuando éstos no puedan ser percibidos a simple vista. Es importante distinguir entre las reacciones químicas que producen cambios observables y las que no los producen pero que aun así se llevan a cabo; así como a distinguir entre cambios físicos y químicos.
Procesos como hervir agua es un ejemplo de cambio físico, que, además, puede no ser fácilmente perceptible en un inicio, mientras que la oxidación del hierro es un ejemplo de cambio químico que puede ser percibido fácilmente.
Cuando en un sistema ocurre una reacción química, en algunos casos, se puede observar la formación de sustancias nuevas o productos. Por ejemplo, la formación de un producto colorido o la liberación o absorción de energía.
Puedes identificar si existirá un cambio químico cuando conoces las propiedades químicas de las sustancias que van a reaccionar, ya que dichas propiedades describirán la manera que una sustancia reaccionará con otra y así formar nuevas sustancias con propiedades físicas y químicas diferentes a las sustancias originales o reactivos.
Una característica que distingue un cambio físico de un cambio químico es que en los cambios físicos no cambia la naturaleza de la materia, mientras que en un cambio químico sí hay un cambio en la naturaleza de la materia, lo que resulta en la formación de nuevas sustancias que antes no se encontraban en el sistema.
Otra característica de las reacciones químicas es la transferencia de energía. Por ejemplo, cuando en una reacción se libera energía en forma de luz y/o calor, como en la combustión del metano.
Muchas sustancias presentan un color característico y cuando reaccionan con otras sustancias y se transforman en sustancias nuevas, presentan un color distinto.
Experimenta, recuerda que en cualquier actividad experimental que realices debes estar acompañado de un adulto y seguir los protocolos de seguridad.
¿Qué necesitas?
- Jugo de limón.
- Infusión de campanita azul (Clitoria ternatea)
- Refresco de limón.
- Azúcar.
- 2 vasos.
¿Cómo lo harás?
En el vaso 1 viertes un poco de la infusión.
Agregas ½ cucharada de azúcar y mezclas.
Ahora, con ayuda de una cuchara o por las paredes del vaso, agregarás el refresco de limón.
En el vaso 2 agregarás una cucharada de azúcar y el jugo de 1 limón y mezclas.
Ahora, agregas poco a poco la infusión.
¿Qué observas?
Un cambio de color, pero ¿Por qué piensas que sucedió esto?
Algunas moléculas responsables de la coloración observada en vegetales, frutas o flores, están compuestos de antocianinas, que se identifican en la naturaleza por su color azul, morado o rojo. Estas sustancias cambian de color dependiendo del pH del medio, por lo que son indicadores naturales de pH.
En esta actividad experimental se presenta una variación de pH, con un medio ácido como el refresco y el jugo de limón, lo que provoca el cambio de color de las sustancias presentes en la infusión, razón por la que observas dicho viraje.
Otra forma de manifestación de una reacción química es la emisión de luz y calor. Por ejemplo, en la combustión de la leña, del carbón o del gas que utilizas para cocinar, los átomos adquieren mucha energía y una parte de ella se emite en forma de luz por lo que percibes una flama que puedes observar.
Imagina qué sucede al encender unos cilindros que se hicieron con el papel de los sobres de té instantáneo. Fue un proceso de combustión.
Aunque también se puede emitir luz sin que aumente la temperatura del sistema. Este fenómeno recibe el término de luminiscencia. Por ejemplo, las barras de luz química. Al doblarlas, dos sustancias diferentes entran en contacto, provocando un cambio químico que libera energía en forma de luz. Seguro en alguna fiesta o concierto has visto esas barras o pulseras.
Realiza nuestra última actividad experimental que será demostrativa.
Recuerda que tu seguridad es importante, por lo que debes estar acompañado de un adulto y utilizar todas las medidas de protección necesarias.
¿Qué necesitas?
- Luces de bengala.
- Cinta adhesiva.
- Dos vasos.
- Agua.
- Cerillos o encendedor.
- Plato de porcelana o base de metal.
¿Cómo lo harás?
Enciende una varilla y la introduces en agua.
Ahora sujeta 3 varillas de bengala con cinta adhesiva, enciende las bengalas y las introduces en el agua.
Lo que observas fue desprendimiento de vapor, luz y calor, ya que la bengala consta de una sustancia oxidante, un combustible, polvo metálico y un aglutinante combustible, los cuales reaccionan.
La bengala puede estar constituida de perclorato de potasio, aluminio y dextrina.
El perclorato de potasio, que es el oxidante, produce oxígeno y su reacción es:
Perclorato de potasio sólido produce cloruro de potasio sólido y 2 moléculas de oxígeno diatómico en forma de gas.
La bengala es una mezcla que se moldea y que recubre una varilla o alambre, una vez que seca y endurece se obtiene la bengala.
El metal en polvo, en este caso el aluminio, se calienta hasta que es incandescente. Una vez que se enciende el extremo de la bengala, arde lentamente hasta el extremo donde acaba el recubrimiento.
Las bengalas no deben usarse en pasteles como velas, ni de otra manera donde se pueden consumir las cenizas, ya que éstas son tóxicas.
De forma natural puedes observar la emisión de luz en las luciérnagas, algunos hongos, entre otros organismos. Dichos organismos presentan luciferina, una sustancia responsable de la luminiscencia sin que se desprenda calor. Al entrar en contacto con el oxígeno del aire, forman sustancias nuevas por la acción catalizadora de una enzima (luciferasa), que libera luz. A esto se le llama bioluminiscencia, que es un mecanismo de comunicación entre los individuos de una misma especie.
Existe gran variedad de cambios químicos, y en muchos de ellos se pueden producir reacciones de efervescencia, de precipitación o de combustión; reacciones en las que hay desprendimiento de luz o calor, así como cambios de color.
El estudio de las reacciones químicas puede ser considerado como parte fundamental de la química, ya que una reacción implica una reestructuración entre los átomos que forman las sustancias originales, en consecuencia, se producen nuevas sustancias que tienen propiedades diferentes a las sustancias iniciales o reactivos.
Es importante que recuerdes que no siempre se manifiestan cambios perceptibles cuando ocurre una reacción química. Sin embargo, una reacción química se puede estar llevando a cabo.
La fotosíntesis es una reacción bioquímica de los organismos autótrofos, los cuales elaboran sus propios alimentos a partir de agua y el dióxido de carbono; reaccionan con la energía luminosa para obtener sustancias nuevas como la glucosa y el oxígeno. La química se encarga de investigar y estudiar estas transformaciones y así predecir qué sucederá con las sustancias.
Como observaste en esta sesión, una reacción química es todo proceso que se lleva en la naturaleza y que da lugar a la formación de nuevas sustancias, es decir, la interacción química entre dos o más sustancias, las cuales pierden sus propiedades formando nuevas sustancias con propiedades diferentes a las originales. Esta interacción puede darse entre elementos y/o compuestos y se puede representar por medio de ecuaciones químicas y de modelos atómicos.
Te puedes asombrar con el conocimiento científico: Los cambios químicos ocurren de manera cotidiana en el cuerpo, en la naturaleza y en la preparación de los alimentos.
NOTA para el docente. Se les invita a revisar estos recursos interactivos que proporcionan la UNAM y el IPN para que sus estudiantes puedan concretar sus conocimientos con respecto al tema de reacciones químicas.
https://www.aev.dfie.ipn.mx/Materia_quimica/temas/tema6/M6A3/ruletav3.html
http://objetos.unam.mx/quimica/reaccionQuimica/index.html
El reto de hoy:
Para aprender y conocer más acerca de las reacciones químicas se te recomienda el libro “La casa química” de José Antonio y Rodrigo Chamizo de la colección de Los Libros del Rincón.
Recuerda que la ciencia no se trata de memorizar lo que aprendes, se trata de saber qué hacer con lo que aprendes.
Se trata de pensar, analizar y explorar. Investiga y descubrir, ya que la ciencia te ayuda a entender lo que sucede a tu alrededor.
¡Buen trabajo!
Gracias por tu esfuerzo.
*Este material es elaborado por la Secretaría de Educación Pública y actualizado por la Subsecretaría de Educación Básica, a través de la Estrategia Aprende en Casa*.


Login to join the discussion