¿Cómo explico las propiedades de los compuestos?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:11
¿Cómo explico las propiedades de los compuestos?
Aprendizaje esperado: explica las características de los enlaces químicos a partir del modelo de compartición (covalente) y de transferencia de electrones (iónico).
Énfasis: explicar las propiedades de los compuestos moleculares y de los compuestos iónicos por medio de su estructura molecular y redes iónicas cristalinas, respectivamente.
¿Qué vamos a aprender?
Padres de familia, si observan algún cambio de actitud en sus hijos, pueden recibir apoyo emocional u orientación en la línea de la vida al 800-911-2000, Centro de atención ciudadana “La Línea de la Vida”.
https://www.gob.mx/tramites/ficha/centro-de-atencion-ciudadana-la-linea-de-la-vida/CONADIC3414
Lee la siguiente frase célebre.
“La satisfacción de la propia curiosidad es una de las mayores fuentes de la felicidad en la vida”.
Linus Pauling.
El propósito de esta sesión es explicar las propiedades de los compuestos moleculares y de los compuestos iónicos por medio de su estructura molecular y redes iónicas cristalinas, respectivamente.
Para facilitar la explicación de este tema se les sugiere a los profesores apoyar en modelos tridimensionales de la estructura de Lewis y en la propuesta didáctica plurimetodológica para introducir el enlace químico en el tercer curso de educación secundaria obligatoria, González-Felipe y colaboradores, 2019.
NOTA para el docente. Se te recomienda la lectura del siguiente artículo; en él encontrarás la forma en que se propicia la participación de los estudiantes y el aprendizaje cooperativo, en la metodología ECBI (enseñanza de las ciencias basada en la investigación).
Consulta la página electrónica:
Los materiales que utilizarás son los siguientes, tu libro de texto de Ciencias con énfasis en química, tu cuaderno, lápices, bolígrafo y colores
¿Qué hacemos?
¿Sabes que es un incendio?
Un incendio es la combustión no deseada de algunos materiales. Una combustión es un fenómeno químico de oxidación exotérmica que se produce con carácter irreversible.
Imagina que pasaría si empieza un pequeño incendio en casa, ¿qué deberías saber para impedir que un incendio se propague?
Puedes elaborar un extintor. Para ello necesitas:
5 gramos de bicarbonato de sodio, 50 ml de ácido acético, una botella de PET de 500 ml, una bolsa de papel de 4 cm de ancho por 2 cm de alto, 20 cm de hilo, 30 gramos de plastilina y un popote o 30 cm de manguera transparente de 9.5 mm de grosor.
Registra las propiedades iniciales de los reactivos en la siguiente tabla.
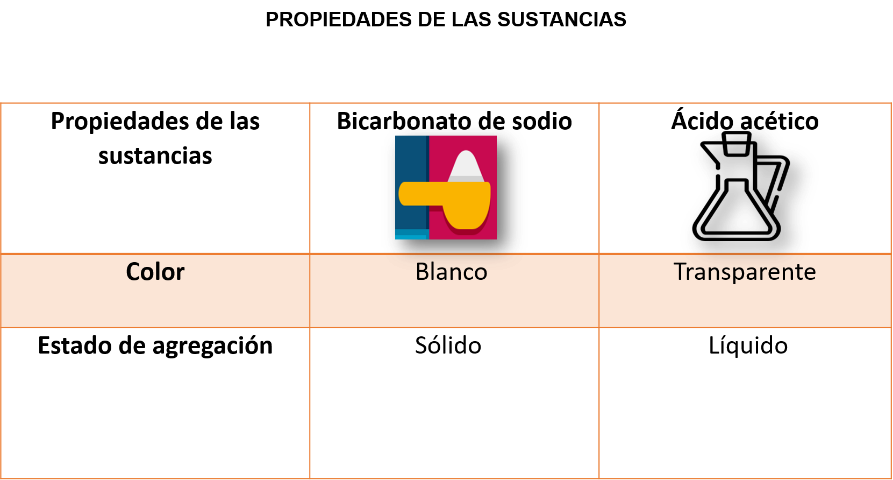
Actividad experimental.
Bicarbonato de sodio en estado sólido, de color blanco. Ácido acético en estado líquido, transparente.
Colocarás el vinagre, una mezcla acuosa de ácido acético (generalmente a 5%, es decir que, por cada 100 ml de mezcla, 5 g son ácido acético) dentro de la botella. Pones el bicarbonato en la bolsa de papel, la sujetas con uno de los extremos del hilo, la introduces en la botella y la dejas suspendida a la mitad, después amarras el otro extremo del hilo a la boquilla y colocas un tapón de plastilina unida a una manguera o popote. El extintor está listo.
Revisa si funciona, simula un incendio con una vela.
Has reaccionar el vinagre y el bicarbonato de sodio agitando la botella, y acerca la manguera a la flama y se apaga.
¿Cómo explicas que el fuego se apaga al acercar el extintor?
El funcionamiento del extintor consiste en la reacción entre el bicarbonato de sodio y el ácido acético del vinagre, lo que produce acetato de sodio, que es una sal en estado sólido de color blanco, agua en estado líquido y dióxido de carbono, un gas que se desprende en forma de burbujas.
Es un gas más pesado que el aire, por lo que al acercarlo a una flama provoca el desplazamiento del oxígeno contenido en el aire, lo que impide la reacción de combustión.
Pero ¿cómo es que una sustancia comienza teniendo ciertas propiedades y al reaccionar con otra, se obtienen productos con propiedades totalmente diferentes a las originales?
Esa misma pregunta se hizo René Descartes; él pensaba que los átomos tenían ganchos y otros ojales mediante los cuales se unían para formar sustancias.
Pero fue hasta el siglo XVII cuando los científicos comenzaron a preguntarse más acerca de las propiedades de los materiales, llegando a importantes descubrimientos científicos en los siglos XVIII y XIX.
Acontecimientos históricos como el ordenamiento de la tabla periódica, la teoría atómica de Bohr y los estudios de electronegatividad de Pauling, permitieron confirmar que las propiedades de los materiales se deben a la estructura interna de los compuestos y que la ruptura y formación de nuevos enlaces dan lugar a nuevas sustancias.
Elabora tu propio extintor e indaga, ¿cuántos tipos de extintores existen? Comparte tus diseños entre tus familiares y comenta sobre las ventajas y desventajas de saber cómo funciona un extintor, así como algunas acciones para prevenir incendios en tu localidad.
Reflexiona y registra en tu libreta sobre otros procesos de la vida cotidiana en los que se formen nuevas sustancias con propiedades distintas a las iniciales. Coloca un mínimo de tres ejemplos e ilústralos.
Analiza con tus profesores el modelo con el cual es posible explicar las propiedades de las sustancias involucradas.
Ahora, analiza qué ocurre a nivel microscópico entre los átomos que forman a los compuestos con los que has experimentado.
Al reaccionar el bicarbonato de sodio con el ácido acético, el ion sodio se separa del ion bicarbonato y se une al acetato, produciendo acetato de sodio.
Al tiempo que el ion bicarbonato pierde un hidrógeno y un oxígeno; convirtiéndose en el gas dióxido de carbono; mientras que el hidrógeno liberado del bicarbonato de sodio y el hidrógeno liberado del ácido acético se unen al oxígeno desprendido durante la formación del dióxido de carbono para formar agua.
Con este modelo y nuestro experimento puedes percatarte de que los cambios que observas a nivel macroscópico dependen de lo que sucede a nivel microscópico.
Continúa experimentando para conocer otras propiedades de las sustancias.
Utilizarás dos sustancias que puedes encontrar en la casa, el cloruro de sodio presente en la sal de mesa y la sacarosa presente en el azúcar.
Revisa dos propiedades de cada una de ellas.
Cloruro de Sodio. Color blanco, estado sólido.
Sacarosa. Color blanco, estado sólido.
A continuación, observarás el comportamiento de las sustancias ante el suministro de la misma cantidad de energía en forma de calor, la solubilidad y la conductividad eléctrica. Colocas 0.5 gramos de cada sustancia en un recipiente metálico diferente, pones los recipientes en contacto con el fuego y los dejarás calentar durante 30 segundos, pasado el tiempo, registrarás tus observaciones.
El cloruro de sodio no se funde, pero la sacarosa sí. ¿A qué atribuyes que la sacarosa se funda y el cloruro de sodio no?
Observa la forma de los cristales de ambas sustancias con el uso del microscopio.
Observa ahora qué sustancia es soluble en agua disolviendo 0.1 gramos de cada sustancia en 25 mililitros de agua, agitas, dejas reposar y registras tus observaciones.
Tanto el cloruro de sodio como la sacarosa son altamente solubles en agua.
¿A qué atribuyen que ambas sustancias sean solubles en agua? ¿Tendrá que ver con los elementos que las conforman?
Observa si las sustancias que estás analizando son capaces de conducir la corriente eléctrica.
Primero debes comprobar si en estado sólido conducen la corriente eléctrica.
Registra tus observaciones.
El cloruro de sodio no conduce la corriente eléctrica en estado sólido y la sacarosa tampoco.
Observaciones.
Hazlo ahora utilizando las disoluciones que preparaste para la prueba de solubilidad. Vacía tus disoluciones en recipientes anchos que permitan verificar con el circuito eléctrico si conducen o no la corriente eléctrica.
Registra tus observaciones: El cloruro de sodio disuelto en agua, ¿conduce la corriente eléctrica? Sí.
La sacarosa disuelta en agua, ¿conduce la corriente eléctrica? No.
¿A qué se deben estas diferencias entre las sustancias analizadas?
Revisa. El cloruro de sodio es una sustancia sólida a temperatura ambiente, no se funde fácilmente, tampoco conduce la corriente eléctrica en estado sólido, no obstante, al mezclarse con el agua forma una disolución que conduce la corriente eléctrica; propiedades que presentan los compuestos iónicos.
La sacarosa es un sólido a temperatura ambiente, capaz de fundirse fácilmente, soluble en agua, no conduce la corriente eléctrica ni en estado sólido ni en disolución acuosa; presenta propiedades de un compuesto molecular.
¿Sabías qué? La Organización Mundial de la Salud (OMS) recomienda disminuir la ingesta de sodio para reducir la tensión arterial y el riesgo de enfermedades cardiovasculares, accidentes cerebrovasculares y cardiopatía coronaria en adultos.
También recomienda reducir el consumo de sodio en los adultos a menos de 2 g/día, es decir, en condiciones normales de salud la ingesta de sal no debe exceder los 5 g diarios.
Para explicar las propiedades que observas durante las actividades experimentales con ambas sustancias, es preciso analizar su comportamiento a partir de su estructura atómica. En la siguiente actividad experimental comenzarás por recordar cómo se unen los átomos.
Primero infla un globo y lo frotas en el cabello, después colocas en un vaso suficiente agua y le haces un pequeño orificio con un palillo, después acercas el globo al agua que está cayendo.
Como puedes observar, el globo atrae al agua, por lo que modifica su trayectoria.
Ahora infla dos globos, frótalos en el cabello y trata de acercarlos.
Podrás darte cuenta de que se repelen, pero ¿por qué sucede esto?
Porque existen fuerzas de atracción y de repulsión entre los átomos presentes en cada material, esto se debe a la interacción eléctrica entre ellas.
Según la ley de cargas: Cargas eléctricas iguales se repelen, como lo que ocurrió entre los globos, y cargas opuestas se atraen, como ocurrió entre el agua y el globo.
El cloruro de sodio está formado por la interacción química de un metal, el sodio, y un no metal, el cloro. Unidos mediante una fuerza electrostática denominada enlace iónico, se atraen por la diferencia de cargas, debido a la transferencia de electrones de valencia entre los átomos de diferentes elementos, lo que caracteriza a un compuesto iónico.
La sacarosa por su parte, está formada por la combinación de 12 átomos de carbono, 22 átomos de hidrógeno y 11 átomos de oxígeno, unidos por la compartición de electrones de valencia provenientes de cada átomo para permitir que los átomos adquieran el mismo arreglo electrónico que el gas noble más cercano a ellos en la tabla periódica. En consecuencia, se produce un compuesto molecular.
Con base en los conocimientos desarrollados, ¿cuáles son las aportaciones del trabajo de investigación de Linus Pauling? Ya comprendiste que la electronegatividad es la capacidad de un átomo para atraer hacía sí los electrones de un enlace. Por la diferencia de las electronegatividades entre dos elementos puedes deducir el tipo de enlace que se presenta entre ellos.
Revisa el caso del cloruro de sodio.
El cloro tiene una electronegatividad de 3.0 y el sodio de 0.9, si restas 3.0 menos 0.9 el resultado es 2.1, por lo que corroboras que se trata de un compuesto con enlace iónico.
En el caso de la sacarosa, el valor de electronegatividad del hidrógeno es 2.5, del carbono 2.5 y del oxígeno 3, observa que la diferencia de electronegatividad entre estos es menor a 1.9, por lo tanto, se trata de un enlace covalente.
Recuerda que la escala de electronegatividad utiliza valores arbitrarios establecidos por convención entre los químicos y que su principal limitante es no contar con un valor absoluto, por lo que los valores son relativos.
Por lo general, cuando ocurren enlaces químicos, los átomos tienden a adquirir una configuración con ocho electrones de valencia en su último nivel de energía y adquieren una configuración más estable semejante a la del gas noble más cercano, acorde con la regla del octeto de Lewis.
Representa los electrones de valencia de los átomos del compuesto cloruro de sodio usando el diagrama de puntos de Lewis, para explicar por medio del modelo de transferencia de electrones cómo se lleva a cabo este enlace. Su fórmula química es NaCl.
Ahora ubica el nombre de cada elemento, inicia de izquierda a derecha. El símbolo del sodio es Na y lo encuentras en el grupo 1 de la tabla periódica que corresponde a la primera columna.
Puedes deducir que tiene sólo un electrón de valencia, ya que pertenece al grupo 1.
Asimismo, antiguamente se consideraba en la familia de los metales alcalinos.
Escribes su símbolo químico y colocas su electrón de valencia. ¿Cómo puede ser estable?
Al interaccionar químicamente con otro elemento se forma un enlace por medio de la transferencia de su electrón de valencia.
Ahora analiza el elemento cloro, se encuentra en el grupo 17, al lado de los gases nobles y su número atómico es 17. ¿Cuántos electrones de valencia tiene en la órbita más alejada del núcleo?
Son 7, lo que significa que sólo necesita uno más para lograr su estabilidad, cumpliendo así la regla del octeto.
Pero ahora, ¿cómo puedes representar este enlace por medio de la estructura de Lewis?
Observa el siguiente video para comprender cómo sucede la unión de los elementos que forman al cloruro de sodio.
- Anexo 2
https://youtu.be/dl64FhhAnNc
(del min. 19.38 al 20.10)
El sodio tiene un electrón de valencia, por lo tanto, para representarlo escribes el signo y colocas el símbolo químico del cloro con siete electrones de valencia.
Este tipo de enlace sucede cuando un elemento metálico se une con un no metal por acción de la fuerza electrostática. Recuerda que se mantienen unidos por la diferencia de cargas, ya que positivo y negativo se atraen.
El sodio se convierte en catión porque cede su electrón.
El cloro se convierte en un anión porque gana un electrón.
Estos enlaces forman redes iónicas, por lo que cada ion de sodio se encuentra rodeado por seis iones de cloro y viceversa.
Las propiedades de los compuestos iónicos se explican porque la atracción entre las cargas de distinto signo es bastante fuerte.
Por ello encuentras las siguientes propiedades: altas temperaturas de fusión y ebullición; son sólidos a temperatura ambiente; solubles en disolventes polares o en agua; no conducen la corriente eléctrica en estado sólido, ya que sus electrones están fijos en la red cristalina, pero sí conducen la corriente eléctrica en disolución debido a que en estos casos los iones sí se pueden mover; son duros, al tener fuerte atracción entre iones, y frágiles, debido a las repulsiones que aparecen al desplazarse una capa sobre otra. - Anexo 3
(del min. 21.39 al 22.20)
Ahora revisa el ejemplo de la sacarosa, compuesto covalente que se forma de carbono, hidrógeno y oxígeno.
Todos los enlaces que se forman al unirse los átomos de los tres elementos son considerados enlaces covalentes, porque se comparten los electrones de valencia y, como se mencionó anteriormente, la diferencia de electronegatividad de los elementos no llega a 1.9, los átomos de carbono logran completar su octeto y el hidrógeno que es una de las excepciones a esta regla, completa su capa de valencia con sólo 2 electrones, al encontrase en el período 1.
Las propiedades de los compuestos moleculares son las siguientes.
- Generalmente, tienen temperaturas de fusión y ebullición bajas, debido a que las fuerzas entre las moléculas son débiles, siendo mayores cuando aumenta la polaridad.
- No conducen la corriente eléctrica, ya que no tienen electrones libres.
- Se disuelven en sustancias con su misma polaridad, es decir, si es apolar en disolventes apolares y en polares cuando es polar.
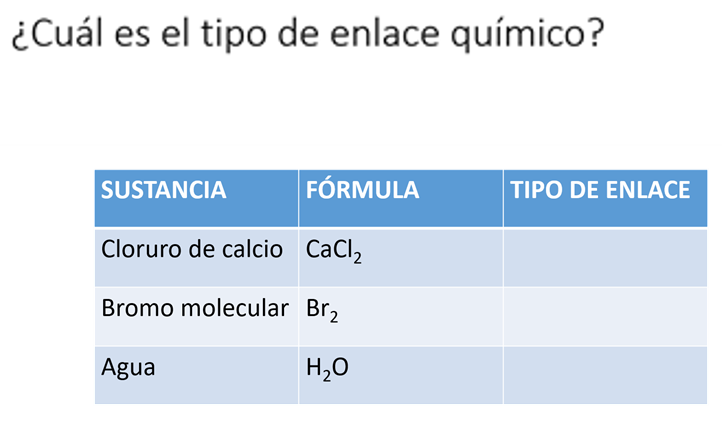
Identifica el tipo de enlace que se da en las siguientes sustancias.
Cloruro de calcio, bromo molecular y agua.
Complementa la tabla y elaboren un dibujo con el modelo de enlace que utilizarían para explicar las propiedades de cada sustancia.
¿Sabías qué? La Organización Mundial de la Salud (OMS) y el Fondo de las Naciones Unidas para la Agricultura y la Alimentación (FAO) declara que el azúcar deriva en obesidad cuando desplaza de la dieta a otros nutrimentos.
La OMS establece que los usuarios deben limitar el consumo de azúcar agregado a menos de 10% de las calorías diarias. Para la mayoría de las personas esa proporción es la cantidad de azúcar que aporta una sola lata de gaseosa. El problema principal del azúcar es que no aporta proteínas, grasas esenciales, vitaminas, minerales, ni fibra.
En esta sesión aprendiste que los modelos de enlace químico permiten describir, explicar y predecir las propiedades de diferentes sustancias químicas; se forman cuando los átomos se unen para adquirir una configuración más estable y cumplir con la regla del octeto de Lewis.
El modelo de enlace iónico es llamado así debido a que durante la unión entre el metal y el no metal se forman iones, producto de la transferencia de electrones. El metal, por ser menos electronegativo, tiende a ceder sus electrones, mientras que el no metal tiende a atraerlos por ser más electronegativo.
Las propiedades que presentan los compuestos iónicos como resultado de la fuerte atracción por la diferencia de cargas, es que forman redes tridimensionales, presentan altas temperaturas de fusión y ebullición, son sólidos a temperatura ambiente y buenos conductores de la corriente eléctrica en disolución acuosa.
En el caso de los compuestos moleculares, cuando los átomos se acercan y se mantienen unidos por los electrones de valencia que comparten, en la mayoría de los casos se generan moléculas.
El enlace covalente se presenta entre elementos no metálicos, presentan bajas temperaturas de fusión y de ebullición cuando se forman moléculas de masa molecular pequeña, son sólidos a temperatura ambiente y no conducen la corriente eléctrica.
A diferencia de los seres humanos, en la ganadería la aportación de sal extra en la alimentación de los animales se hace con el fin de evitar la deshidratación, favorecer la digestión y la asimilación de los alimentos, lo que contribuye a un óptimo crecimiento, desarrollo y reproducción del ganado, que a su vez favorece una alta productividad de carne, leche y un mejor estado de salud.
El reto de hoy:
Para seguir aprendiendo visita el portal académico CCH UNAM; en él encontrarás material para consultar y poner en práctica tus conocimientos relacionados con los enlaces químicos.
http://www.dcb.unam.mx/cerafin/bancorec/ejenlinea/12_Enlaces_F_intermoleculares.pdf
En la Nota para el docente, se mencionó que te apoyas en la propuesta didáctica plurimetodológica para introducir el enlace químico en el tercer curso de educación secundaria obligatoria, González-Felipe y colaboradores, 2019.
El siguiente esquema se queda como referencia con la metodología empleada para lograr el aprendizaje esperado de esta sesión.

¡Buen trabajo!
Gracias por tu esfuerzo.
*Este material es elaborado por la Secretaría de Educación Pública y actualizado por la Subsecretaría de Educación Básica, a través de la Estrategia Aprende en Casa*.


Login to join the discussion