¿Qué significa el número de Avogadro?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:12¿Qué significa el número de Avogadro?
Aprendizaje esperado: relaciona la masa de las sustancias con el mol para determinar la cantidad de sustancia.
Énfasis: explicar que las reacciones químicas se producen entre un enorme número de átomos.
¿Qué vamos a aprender?
Inicia con la frase célebre de Jean Baptiste Perrin, famoso físico y químico francés: “la ciencia está hecha de dos partes: primera, saber que se sabe lo que se sabe; segunda, saber que no se sabe lo que no se sabe”.
En esta ocasión aprenderás que las reacciones químicas se producen entre un enorme número de átomos. Comprenderás el significado del número de Avogadro y analizarás la ley de Avogadro y los gases ideales.
Para esta sesión necesitarás:
●Tu bitácora científica que es tu cuaderno de Ciencias. Química.
●Libro de texto de Ciencias 2.
●Lápiz, colores, bolígrafo.
●Tabla periódica localizada en tu libro.
Durante las sesiones pasadas has aprendido muchas cosas interesantes como, por ejemplo, las mezclas, las reacciones químicas y más. Estudias algunas propiedades de la materia como la masa, el volumen, la temperatura, entre otras, así como las unidades que sirven para medirlas.
Durante este tiempo se ha abordado las moléculas, átomos, iones ¿cómo puedes medir su masa e inclusive estimar el número de átomos contenidos en una porción de materia?
Puedes describir a muchos compuestos químicos mediante sus propiedades físicas y químicas. Efectivamente, es posible estimar la cantidad de átomos que contiene una sustancia.
Como los átomos, iones y moléculas son tan pequeños para poder saber cuántos hay en una muestra de sustancia, es necesario agruparlos, más que contarlos de forma individual.
Esta forma de contar agrupando se utiliza con otros objetos comunes. Por ejemplo, si fueras a comprar un ramo de rosas probablemente no pediría doce o veinticuatro, sino una docena o dos.
De modo similar, no compras dos zapatos, sino un par de zapatos, o una gruesa de lápices.
Cada uno de los conjuntos como la docena y la gruesa, representan un número específico de artículos. Estos conjuntos facilitan el conteo de los objetos. Una docena siempre tiene 12 objetos, 1 gruesa siempre tiene 144 objetos, 1 par siempre tiene 2 objetos.
Los químicos también necesitan un método adecuado para contar el número de átomos, moléculas, partículas o iones en una muestra de una sustancia.
Los átomos y las moléculas son extremadamente pequeños, hay muchos de ellos aún en la muestra más pequeña, por lo que es imposible contarlos, razón por la cual los químicos crearon su propia unidad de medida llamada mol.
Puedes utilizar distintos recursos para apoyarte y para despertar tu curiosidad e interés. Revisa la dirección electrónica, donde encontrarás bellas imágenes astronómicas, a partir de las cuales puedes llevar a la reflexión sobre los elementos que componen las estrellas, nebulosas, planetas y otros astros, así como sus propiedades.
https://apod.nasa.gov/apod/archivepix.html
¿Qué hacemos?
Desde las primeras ideas referentes al átomo, distintos científicos se preguntaron sobre la posibilidad de medirlos, pesarlos y contarlos.
¿Te imaginas la cantidad de átomos, moléculas, iones, y partículas más pequeñas que constituyen toda la materia?
La cantidad es inmensa. Uno de los científicos que realizó estudios con respecto a este planteamiento fue Lorenzo Romano Amadeo Carlo Avogadro, conde de Quaregna e Ceretto. Nació en Turín, Italia en el año de 1776, fue abogado, eclesiástico y además dedicó gran parte de su vida a sus estudios en física y matemáticas.
Amadeo Avogadro enfocó sus estudios al comportamiento de los gases, lo que lo llevó a proponer que los gases estaban formados por moléculas diatómicas, es decir, que en el gas hidrógeno, las moléculas de este elemento están formadas por dos átomos de hidrógeno y que en el gas cloro, las moléculas están formadas por dos átomos de cloro. Además, consideró que, en una reacción química, una molécula debe reaccionar con una o varias moléculas, dando como resultado un producto.
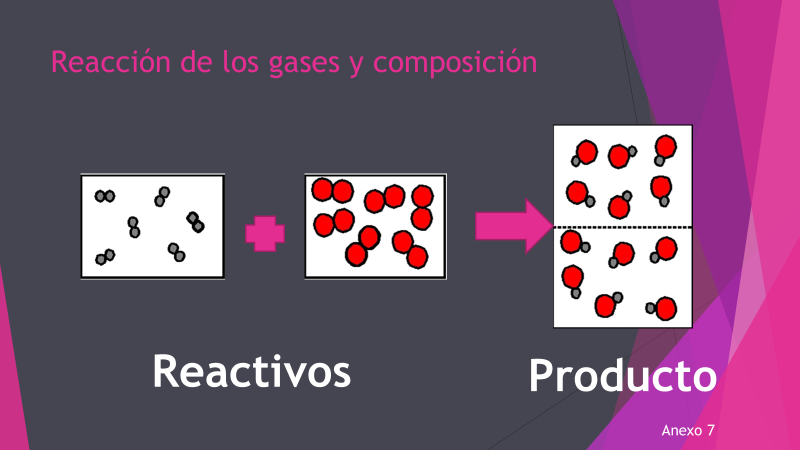
Como identificaste, debe existir una relación entre el número de moléculas presentes en los reactivos y el de los productos. Avogadro propuso que el volumen de un gas, a una presión y temperatura determinadas, es proporcional al número de átomos o moléculas que lo conforman. Lo anterior, establece una relación directa entre el volumen de cualquier gas y el número de moléculas que contiene. En el ejemplo puedes observar que en volúmenes iguales (los rectángulos), siempre hay el mismo número de moléculas.
Con base en estas afirmaciones, Avogadro establece una ley que lleva su nombre y que argumenta que: volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de moléculas.
Con la misma ley se argumenta que:

“Un específico número de moléculas de dos gases diferentes ocupan el mismo volumen en idénticas condiciones de presión y temperatura".
Es un poco complicado, pero para ayudar a pensar en ello, vas a inflar un globo. Como puede verse a mayor cantidad de gas, mayor será el volumen, y a menor cantidad de gas, menor volumen. Lo que fue muy importante es que Avogadro pensó que esto ocurría para distintos gases, así cuando reaccionaban volúmenes iguales de distintos gases como en el ejemplo con hidrógeno y cloro se podía suponer que reaccionaban el mismo número de moléculas de cada uno.
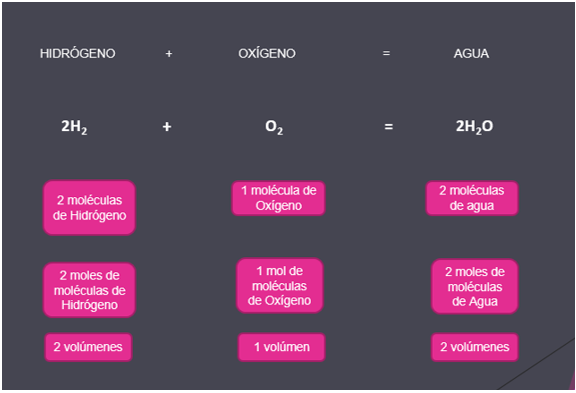
Ahora observa el ejemplo del agua:
De acuerdo con Avogadro, el número de partículas de un gas está relacionado con el volumen que ocupa, como se observa en la imagen, con respecto al volumen de oxígeno, y las dos moléculas del hidrógeno. Por ello, la relación sencilla que se forma entre un número de partículas también se podría extender a los volúmenes que ocupan los gases, que aquí su relación sería dos a uno. Por lo tanto, con base en Avogadro, volúmenes iguales de gases diferentes tienen el mismo número de partículas, las relaciones del mol han de ser iguales a las relaciones volumétricas.
Uno de los primeros científicos que trataron de calcular el número de moléculas contenidas en un volumen determinado de un gas fue Johann Josef LoSchmidt, químico y físico australiano cuya obra principal se centra en la Teoría cinética de los gases y la Termodinámica.
A partir de sus investigaciones sobre la cinética de los gases pudo determinar y calcular por vez primera el valor exacto del tamaño de las moléculas contenidas en el aire.
Sin embargo, pese a que estimó erróneamente el número de moléculas que hay en un centímetro cúbico de aire, dio mayor claridad para lograr entender que sí es posible calcular el número de átomos.
A pesar de que su resultado no fue acertado, fue la base para posteriores investigaciones con la finalidad de resolver esta incógnita.
En la sección de la química en la vida cotidiana dice:
Muchos de los envases de alimentos que compramos tiene gas para mejorar el aislamiento. Por ejemplo, para garantizar la frescura de la comida, en la industria alimentaria se utiliza en el hielo seco un gas compuesto por dióxido de carbono en estado sólido. Su baja temperatura lo hace apto para la conservación, la congelación y el transporte de alimentos. Algunos sistemas de envasado de alimentos, como el envasado en atmosfera protectora se utilizan gases para que se conserven los alimentos. Los más comunes son el oxígeno, el CO2 y el nitrógeno. El tipo y la proporción de gas que debe ir en cada envase depende del tipo de comida y de los cambios naturales que sufra cada alimento.
Para garantizar la frescura de la comida, muchos de los alimentos que consumes son empacados o almacenados en atmósferas controladas, para mantener o mejorar su calidad.
Por ejemplo, algunos alimentos se mantienen en cámaras de conservación. Estas cámaras normalmente tienen bajas temperaturas, pero también bajos niveles de oxígeno, entre otras características, que contribuyen a ralentizar los procesos metabólicos de la fruta, alargando su vida comercial.
Por otro lado, en ocasiones es necesario que la fruta madure en tiempos cortos, por lo que es necesario acelerar el proceso metabólico de los frutos.
Generalmente, en estos casos se emplean cámaras de maduración, con atmósferas que contienen gas etileno, ya que este gas contribuye a su maduración.
Ten listo tu diccionario, dispositivo electrónico, o tu libro de texto, enciclopedia donde puedas encontrar información, para investigar ¿qué es el mol?
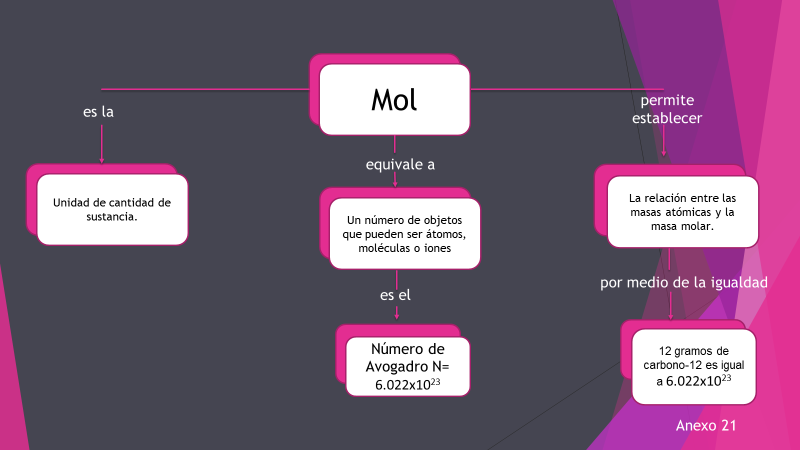
El mol es la unidad básica del Sistema Internacional de medida (Si), utilizada para medir la cantidad de sustancia. Es el número de átomos de carbono que hay exactamente en 12 g de carbono-12 puro.
El número de Avogadro fue nombrado así por Jean Baptiste Perrin como el número de átomos en un mol de hidrógeno.
Solo que la física y química tenían diferentes conceptos para definirlo, e inclusive referencias, como el hidrógeno y el carbono-16.
Pero fue en 1960, que la IUPAC retoma y somete a prueba esta idea, acordando que se tomaría como referencia el carbono-12.
El carbono 12 es el más abundante de los isótopos estables del carbono, se estima en 98.9% su abundancia en el planeta Tierra. Está conformado por 6 protones, 6 neutrones y 6 electrones.
Por lo cual adquiere particular importancia al usarse como referencia en el cálculo de unidades de átomos, iones, moléculas, en una sustancia.
En la ciencia todos se tienen que poner de acuerdo, ser concretos y considerar que el trabajo científico no ocurre de forma aislada.
Es un trabajo en conjunto, y todos los científicos y especialistas pueden aportar ideas. ¿entonces que unidad de medida tiene el mol?

Un mol contiene exactamente 6.022 140 76 × 1023 entidades elementales. Este número es el valor numérico fijo de la constante de Avogadro, NA, cuando se expresa en mol, se llama número de Avogadro. Con base en una de las últimas revisiones de la IUPAC.
Con lo anterior se puede decir que 1 mol de carbono-12 tiene 12 gramos. Entonces, también se puede decir que 12 gramos de carbono-12 tienen 6.022 x1023 átomos.
El mol es útil porque ayuda a pasar de lo que no se puede ver (átomos, iones y moléculas) a lo que sí se puede “observar” en el laboratorio (gramos, miligramos).
El número de Avogadro es un número enorme escribe todos los números que corresponden a la cifra 6022 000 000 000 000 000 000 00
Este número se puede expresar de otra manera, recuerda un poco de tus clases de matemáticas, con la finalidad de expresar de manera práctica la cifra como notación exponencial quedando de la siguiente manera:
6.022x1023 mol
Entonces de la misma manera que el metro es la unidad fundamental de longitud, y el segundo la del tiempo, mol es la unidad fundamental de cantidad de sustancia.
¿Sabías que? Aunque lleve su nombre, este número no fue propuesto por Amadeo Avogrado. De hecho, el italiano nunca llegó a conocerlo. Fue el francés Jean Perrin, premio Nobel de Física en 1926, que, con base en el desarrollo de las teorías de Avogrado, propuso dar su nombre a un concepto fundamental en el estudio de las magnitudes de las sustancias a nivel atómico y molecular.
El número de Avogadro es una cifra gigantesca, como debe ser para contar partículas extremadamente pequeñas. Basta pensar que un mol de canicas cubriría la superficie de la Tierra hasta una profundidad de más de 6 kilómetros.
Observa el ejemplo.
- Esfera 1: hidrogel color rojo y blanco.
La partícula representativa del mol de agua es la molécula de agua de un enlace covalente. - Esfera 2: hidrogel color rosado
El mol de cobre es el átomo de cobre. - Esfera 3: hidrogel color blanco y verde.
Mol de cloruro de sodio es la fórmula unitaria, de un enlace iónico.
Cuando tomas la masa de los átomos que aparecen en la tabla periódica y la expresas en las mismas unidades (gramos, kilos, toneladas) tienes la misma cantidad de partículas.
Por ejemplo: una docena de limones tiene aproximadamente el doble de la masa de una docena de huevos. La diferencia de masa es razonable debido a que los limones son diferentes de los huevos en composición y tamaño.
Aunque un mol de cada elemento o molécula tiene el mismo número de entidades, no tiene la misma masa. Observa un ejemplo con tres tipos diferentes de dulces.
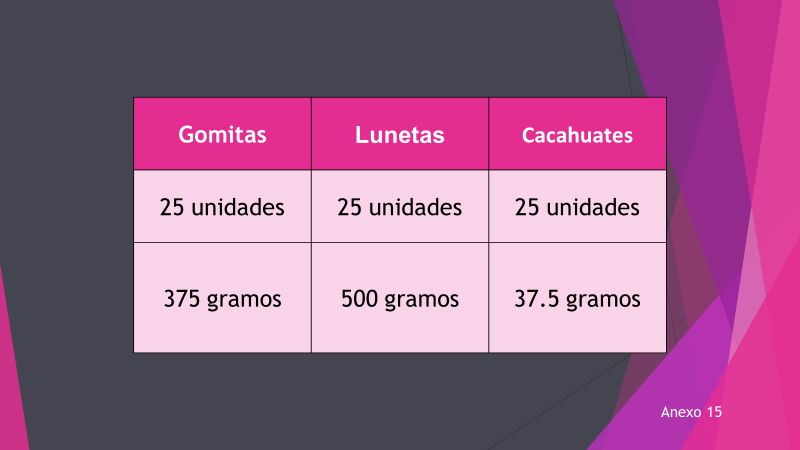
Aquí hay tres cajas, cada una con el mismo número de dulces, verifica si la masa de cada caja es la misma.
El contenedor de gomitas tiene 25 gomitas, con una masa de 375 g, el segundo contenedor contiene 25 lunetas, con una masa de 500 g y, por último, el contenedor que tiene 25 cacahuates, tiene una masa de 37.5 g.
¿Te atreverías a calcular mentalmente la cantidad de gomitas que hay en 750 g?
Si observas, aunque cada contenedor tiene el mismo número de entidades, en el ejemplo, el mismo número de dulces, éstas tienen diferente masa. Lo mismo pasa con los átomos y las moléculas.
Ahora imagina que tienes una caja con 10 moléculas de hidrógeno, es decir, estas moléculas están formadas por la unión de 2 átomos de hidrógeno en estado gaseoso, así se encuentran en la naturaleza. Si cada molécula de hidrógeno tiene 2 unidades de masa atómica y tenemos 10 moléculas ¿qué valor tiene su masa molecular?
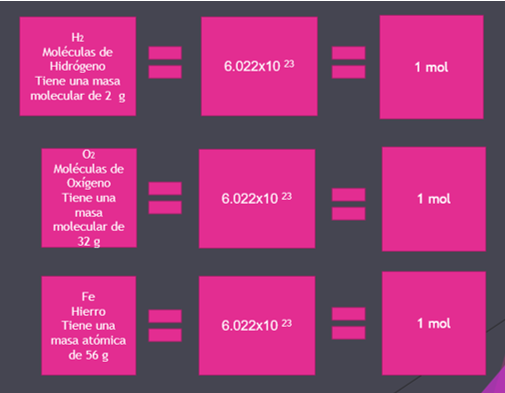
Ahora, por ejemplo, una molécula de hidrógeno tiene una masa de 2 g, esto equivale a 1 mol que significa que tiene 6.022x10 23 moléculas, si revisas el oxígeno molecular (O2), tiene una masa de 32 g, esto indica que en 32 g de oxígeno molecular hay 6.022x1023 moléculas, lo que equivale a un mol.
Por último, tienes el hierro, tiene una masa de 56 g y sigue teniendo el mismo número de átomos, el correspondiente al número de Avogadro, y equivale a un mol. Es muy importante que identifiques que los datos que cambian solo son las cantidades de masa y se conserva el número de partículas.

En esta imagen puedes observar que 1 mol de diferentes sustancias tiene diferentes masas.
Por lo tanto, un mol es la unidad para representar la cantidad de sustancia y un mol contiene el número de Avogadro de partículas (átomos, moléculas, iones, electrones).
El número de Avogadro (NA) tiene un valor de 6.022 x1023 partículas. La masa de un mol de átomos es la masa atómica expresada en gramos (masa molar: Se mide en g/mol)
Alguna vez te has preguntado ¿qué tan delgada es la membrana de una burbuja de jabón?
Propósito: Reflexionas sobre las dimensiones de la membrana de una burbuja de jabón.
Investigación previa:
¿Cómo se expresan las dimensiones menores a los milímetros?
Investiga 5 ejemplos de objetos más pequeños que lo que se puede percibir a simple vista y sus dimensiones.
Necesitarás:
- Un plato lo más grande posible.
- Detergente líquido.
- Glicerina.
- Un gancho de metal para colgar la ropa, o un embudo de plástico, o un pedazo de alambre en forma circular forrado con estambre.
Realiza el procedimiento:
- Prepara una disolución jabonosa mezclando en volumen una parte del detergente, dos y media partes de glicerina y tres partes de agua.
- Introduce el embudo, el gancho o alambre y sopla. Tendrás una o varias burbujas de jabón.
Predicción:
¿De qué ancho es la membrana de la burbuja de jabón? Predice tomando como base los siguientes valores aproximados en nanómetros (1 nanómetro es igual a 1 X 10-9 metros).
- El ancho de un cabello humano 100 000 nm.
- El ancho de una célula roja en la sangre 10 000 nm.
- La longitud “normal” de una bacteria 1000 nm.
- El ancho de una partícula de polvo 800 nm.
- La longitud de onda de la luz roja 650 nm.
- El ancho de un chip de computadora 100 nm.
- La distancia entre dos hélices del ADN 2 nm.
- El ancho de un átomo de carbono 1 nm.
Justifica la predicción.
Observación:
- Realiza la actividad experimental y compara el grueso de la burbuja con el de un cabello humano.
- Observa qué sucede, elabora dibujos de ello y acompaña cada dibujo con una descripción de lo que ocurre.
Explicación:
- Explica con tus palabras lo que sucede y compáralo con tu predicción.
Recuerda compartir tus resultados con tu maestra o maestro de forma creativa y segura.
El número de Avogadro es un número gigantesco, tanto que nos resulta complicado de poder leer. Por ejemplo, si llenaras un número de Avogadro de vasos de agua del océano Atlántico, lo dejarías totalmente seco.
Si tuvieras un paquete de 100 hojas de colores acomodadas midiendo aproximadamente 1 centímetro de alto; si apilaras un mol (es decir, un número de Avogadro) de hojas, la torre resultante mediría 60 billones de kilómetros de alto.
En esta sesión aprendiste que Amadeo Avogadro realizó investigaciones de los gases, y estableció una ley que dice “Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de moléculas”.
El mol es la unidad de medida para calcular el número de átomos, moléculas, iones y partículas que hay en la masa de una sustancia.
También aprendieron que el número de Avogadro tiene como referencia al carbono-12, isótopo muy abundante en el planeta Tierra.
Sorprendente, el número de Avogadro es enorme, sin embargo, se puede expresar con notación científica 6.022x1023, valor que estima la cantidad de átomos, moléculas, iones y partículas presentes en un mol de sustancia.
Observa el siguiente diagrama.
El reto de hoy:
Para seguir aprendiendo y construyendo tus saberes, revisa de los Libros del Rincón, Ciencia para Nicolás del autor Carlos Chordá Pamplona. Todo el libro es genial, revisa en específico el capítulo titulado “Cuenta con el mol”.
¡Buen trabajo!
Gracias por tu esfuerzo.
Para saber más:
Lecturas


Login to join the discussion