¿Cuáles son las aportaciones del trabajo de Lewis?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:12¿Cuáles son las aportaciones del trabajo de Lewis?
Aprendizaje esperado: explica la importancia del trabajo de Lewis en relación con su propuesta de que en el enlace químico los átomos adquieren una estructura estable.
Énfasis: explicar y valorar la importancia del trabajo de Lewis en relación con su propuesta de que en el enlace químico los átomos adquieren una estructura estable.
¿Qué vamos aprender?
Lee la siguiente frase célebre de Ruy Pérez Tamayo, investigador y divulgador de ciencia mexicano.
"La verdad es que yo he definido la ciencia como una actividad humana creativa. Se requiere el mismo tipo de inspiración, de imaginación y de aventura del pensamiento que las otras profesiones creativas como son las artísticas".
Para comprender las propiedades y el comportamiento de la materia, los químicos emplean modelos. En esta sesión aprenderás las propuestas y aportaciones de Lewis que permitieron comprender mejor la forma en la que se unen los átomos para formar moléculas.
Para esta sesión necesitarás tu cuaderno, tu libro de texto, lápiz, colores y bolígrafo.
Las palabras o conceptos clave de esta sesión son:
- Modelo atómico cúbico
- Electrones de valencia
- Regla del octeto
- Diagrama de Lewis
- Gases nobles
- Estabilidad de átomos
¿Qué hacemos?
¿Alguna vez te has preguntado cómo es que los químicos propusieron las fórmulas de los compuestos químicos?
En sesiones anteriores aprendiste sobre el modelo atómico, las regularidades de la tabla periódica, electrones de valencia, enlaces y formación de compuestos, pues bien, en esta sesión retomarás estos conceptos.
Los químicos se han interesado siempre en estudiar la forma en que se unen los átomos ya que esto permite comprender a la materia, pero ¿cómo se representa a la materia para poder comprender estas uniones? ¿por qué el agua está formada por dos átomos de hidrógeno y uno de oxígeno? ¿no es posible que la molécula del agua se formara con 3 átomos de hidrógeno y dos de oxígeno?
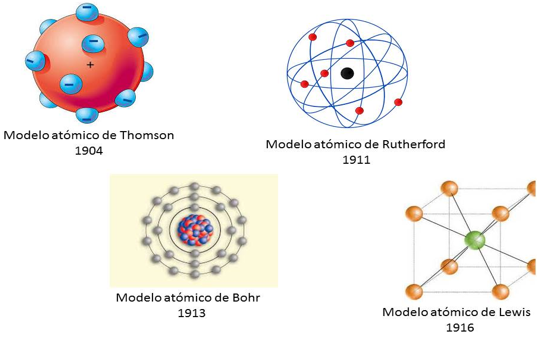
Ante este tipo de interrogantes los científicos utilizaron su conocimiento y creatividad, propusieron diferentes modelos para explicar la estructura de un átomo y cómo se realizaban las uniones entre ellos para formar sustancias nuevas.
En 1897, Thomson demostró la existencia del electrón y varios físicos y químicos no tardaron en considerar que esta partícula ofreciese alguna forma nueva de entender las uniones entre los átomos.
En 1904 cuando Thomson desarrolló una teoría atómica en la que los electrones podían circular en capas externas del átomo, en ese mismo año Abegg formuló una regla más explícita, “la regla del ocho” que correspondía con las regularidades periódicas.
Durante y después de la Primera Guerra Mundial, cuando Kossel y Lewis desarrollaron de manera independiente teorías electrónicas del enlace químico por compartición de electrones, un concepto que amplió con éxito Irving Langmuir.
Junto a Gilbert Lewis, Langmuir desarrolló la llamada teoría Langmuir-Lewis sobre las interacciones químicas y las valencias.
En esta nueva teoría en el segundo y tercer periodo de la tabla periódica se sitúan 8 elementos en cada uno, el de mayor número atómico de cada periodo tiene un “octeto de electrones” estable y que no interviene en enlaces, los gases nobles.
Los elementos anteriores a estos gases nobles del periodo 2 y 3 presentan en su última capa menos de 8 electrones, los electrones de valencia.
Langmuir distinguía que existe una transferencia de electrones (enlace iónico), además hay una compartición de electrones, en el que dos electrones, uno de cada átomo que formaba un enlace se compartían más o menos igualitariamente a lo que se denominó enlace covalente.
Langmuir trabajaba junto a una talentosísima científica llamada Katherine Blodgett cuando publicó sus aportaciones sobre el enlace covalente.
Y al mismo tiempo tanto Niels Bohr y sus colaboradores desarrollaron la teoría de la estructura electrónica de los átomos, usando las regularidades de la tabla periódica.
Las investigaciones, descubrimientos y estudios realizados por Lewis representaron un gran avance en la ciencia, especialmente en el área de química, fisicoquímica e ingeniería térmica.
Fueron tan trascendentales que aún en la actualidad se sigue enseñando el modelo cúbico por su simplicidad ya que, puede explicar de forma sencilla el enlace químico y cómo un par de electrones mantienen unidos a dos átomos. El fundamento del modelo son los pares electrónicos, la estabilidad de los compuestos se explica porque completan 8 electrones en su capa más externa. Su trabajo lo coloca entre los científicos más importantes de nuestros tiempos.
Las investigaciones de Gilbert Lewis fueron muy amplias, pero se hizo famoso por la teoría de los enlaces químicos y la definición del ácido –base que formuló en 1923 de la cual aprenderás en sesiones posteriores.
Lee la siguiente lista de las destacadas aportaciones de Lewis que estudiarás en esta sesión:
- El modelo del átomo cúbico
- La regla del octeto
- Los electrones periféricos
- El diagrama de Lewis
- Teorías de enlace covalente
El modelo atómico de Lewis fue uno de los primeros modelos atómicos que intentó explicar los electrones de valencia. El modelo cúbico atómico de Lewis, aunque diferente, es un predecesor del modelo atómico actual. Es importante aclarar que en esa época Thomson apenas había propuesto el electrón como una partícula que constituía los átomos y que en un lapso de tiempo muy corto también se estaba proponiendo el modelo de Bohr que “acomodaba” los electrones en capas y el modelo de Rutherford para el núcleo era muy reciente.
De acuerdo con el modelo cúbico de Lewis los electrones externos se hallan ubicados en los vértices de un cubo que representa un átomo.
En cada átomo hay una parte esencial que permanece inalterada en los cambios químicos llamada kernel y está formada por el núcleo, positivo y los electrones internos.
Los electrones de las capas externas son los que intervienen en las reacciones químicas y formación de enlaces.
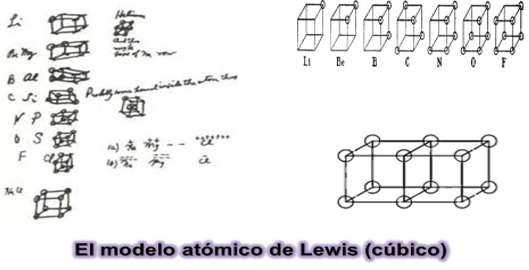
Por lo tanto, en el modelo cubico de Lewis, son los que se representan en los vértices del cubo. Estos son conocidos como electrones de valencia.
Se construyeron algunas representaciones del modelo cúbico atómico para que puedas observar lo que Lewis quiso demostrar con ellos, analiza cada uno.
- LITIO. El átomo de este elemento tiene un electrón de valencia. Entonces, en el modelo cúbico solo verás representado a ese electrón. Se coloca solo una esfera de unicel en uno de los vértices del cubo.
- BERILIO. El átomo de este elemento tiene 2 electrones de valencia, por lo tanto, debes colocar 2 esferas de unicel en los vértices del cubo.
- BORO. El átomo de este elemento tiene 3 electrones de valencia ¿cuántos electrones debes colocar en el modelo cubico que lo representa? Se deben colocar 3 esferas en los vértices para representarlos.
- CARBONO ¿Cuántos electrones de valencia tiene? Si cuentas vas a saber que son 4. Colocas el electrón de valencia
- NITRÓGENO. Los átomos de este elemento tienen 5. Se coloca el electrón de valencia
- El OXÍGENO cuenta con 6 electrones de valencia, es decir, que sólo le faltan 2 para completar su capa de valencia. Colocas el electrón de valencia
- El FLÚOR es el elemento que tiene 7 electrones de valencia y solo le falta 1 para ser estable como el gas noble llamado neón.
Los átomos de los gases nobles son estables debido a que su capa más externa está completa. Cabe señalar que el helio tiene su capa completa, porque al encontrarse en el primer periodo tiene el número máximo de electrones que son 2. Sin embargo, no cumple con la regla del octeto, debido a que está menciona que deben completarse ocho electrones en la capa de valencia.
La representación de los gases nobles como el Neón, Argón, Kriptón, Xenón y Radón mediante el modelo cúbico de Lewis quedaría de esta manera.
Todos los vértices están ocupados y si sumas cada electrón te va a dar un total de 8, que es el máximo de electrones que puede haber en la capa de valencia de los átomos, como se ilustra en el modelo que estás revisando.
Gilbert N. Lewis estableció por medio de su modelo cúbico que los átomos tienden a formar enlaces compartiendo un par de electrones hasta completar su capa de valencia uniéndose con átomos iguales o diferentes, es decir, con otros elementos químicos.
El enlace iónico se forma por la atracción electrostática que se genera cuando un átomo dona un electrón al otro, generándose así uno fuertemente electropositivo y otro fuertemente electronegativo que son atraídos mutuamente.
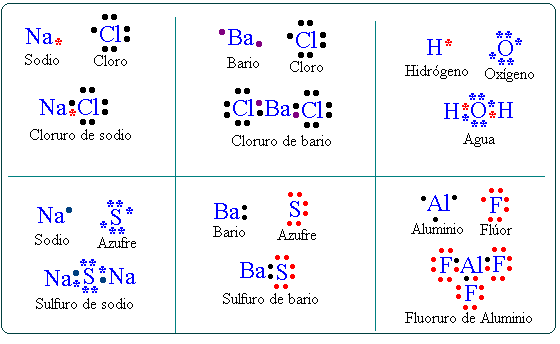
Como ejemplo usarás el compuesto de cloruro de sodio (sal común).
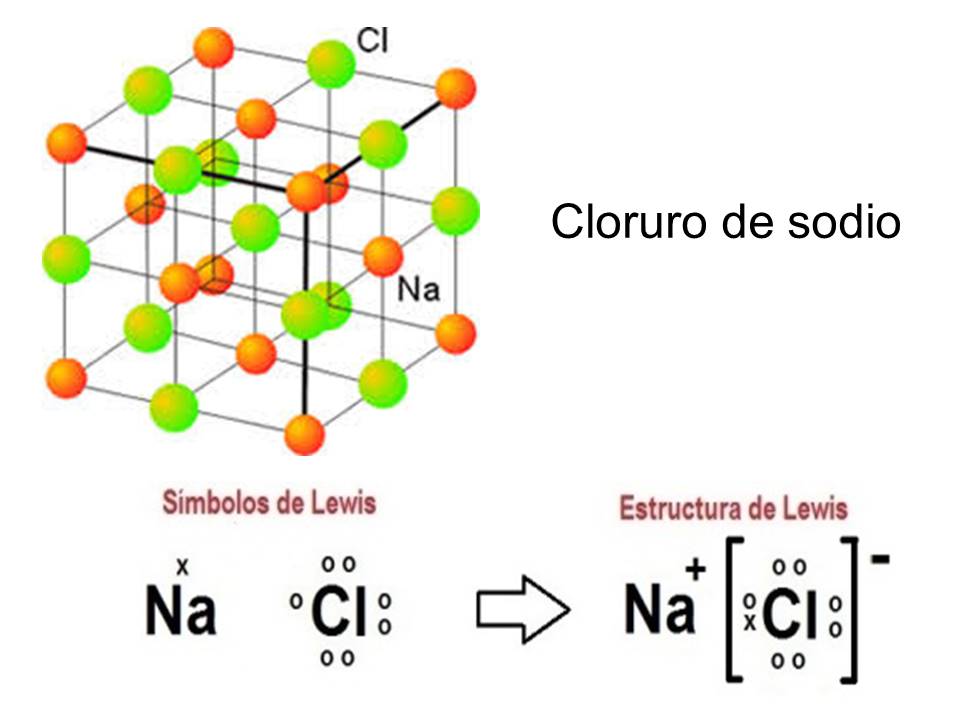
El átomo de cloro tiene 7 electrones de valencia y el de sodio tiene solo 1, como al cloro le falta solo uno para completar su capa de valencia, el átomo de sodio cede su único electrón de valencia para que el cloro logre la estabilidad. Se quedan unidos por medio de la fuerza electrostática que se genera formando el ion sodio y el ion cloro.
En los enlaces covalentes se comparten pares de electrones de valencia. Revisa el siguiente ejemplo: HCl, el ácido clorhídrico se compone de un átomo de hidrógeno y uno de cloro. Recuerda que el hidrógeno es estable sólo con 2 electrones de valencia por encontrarse en el primer periodo.
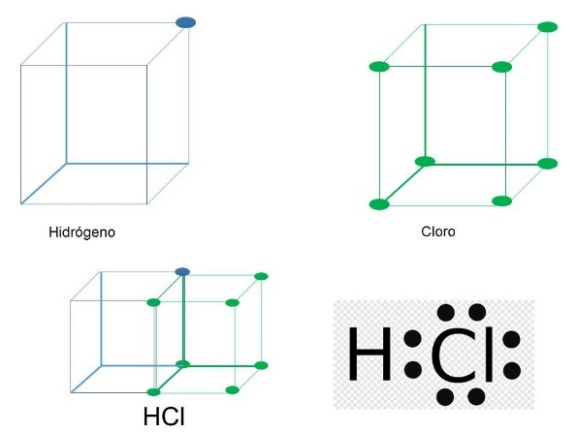
El átomo de hidrógeno posee un electrón de valencia mientras que el cloro tiene 7, el hidrógeno y cloro comparten un par de electrones, como puedes observar en este modelo cúbico de Lewis.
Con este modelo Lewis también propuso la formación de un enlace doble, formado por medio de la compartición de dos pares de electrones, lo representó de la siguiente forma.
Con este modelo, en este enlace covalente se comparten 2 pares de electrones de valencia, es decir una cara de los cubos y ambos completan sus 8 electrones. Este ejemplo se puede usar para representar la unión de la molécula de oxígeno.
Aunque útil para la comprensión de la formación de ciertos enlaces, el modelo cúbico tiene una limitante, no es útil para representar un triple enlace, como el del monóxido de carbono, Posteriormente se desarrolló el diagrama de Lewis, también llamada diagrama punto, útil para representar la formación de enlaces sencillos, dobles y triples.
¿Qué son los electrones de valencia? Son los electrones que se encuentran en la capa más externa del átomo, siendo estos los responsables de la interacción entre átomos para la formación de enlaces.
Los electrones en las capas o niveles externos son aquellos que participan en los enlaces químicos para la formación de moléculas de elementos o compuestos, así como de compuesto iónicos.
Lewis contribuyó en el desarrollo de la regla del octeto, aunque él no la propuso, pero con ello se puede comprender la formación de compuestos, ¿qué establece esta regla?
Gilbert N. Lewis estableció en 1916 la teoría del enlace químico en la que se establece la tendencia de los átomos para completar su último nivel de energía, la capa de valencia, con una cantidad de 8 electrones, al compartir un par de electrones que forman un enlace covalente.
Lewis y Langmuir enunciaron la regla del octeto al observar la manera en que se combinan entre sí los elementos. Así, advirtieron que todos tienden a la configuración estructural del gas noble más cercano en la tabla periódica.
Por propiedades propias de algunos elementos y como toda regla tiene excepciones, quedan excluidos el oxígeno, el hidrógeno, el nitrógeno, el carbono, el aluminio, el berilio, el boro, el flúor, el fósforo y el azufre, que se organizan de manera diferente para conseguir la estabilidad en sus compuestos.
Sin embargo, la regla del octeto es útil para predecir el comportamiento de muchas otras sustancias ya que al estar unidos los átomos adquieren una situación más estable al tener 8 electrones en su capa externa.
Lewis, en 1916, presentó a la comunidad científica un modelo sencillo para representar los electrones de valencia, tanto los que participan en la formación de enlaces como los que no, en una molécula.
Aunque es una representación sencilla, pues no refleja la geometría de la molécula, permite saber cuántos electrones de valencia interactúan, formando enlaces simples, dobles o triples.
Se refiere al diagrama de Lewis, útil para representar átomos y moléculas donde el símbolo del elemento se rodea con puntos que representan los electrones en la capa de valencia.
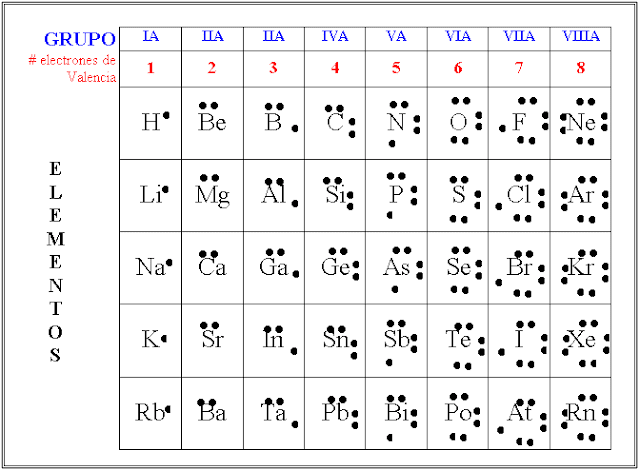
¿Notas algo en común entre los elementos de los grupos de la tabla periódica? ¿Cuántos electrones de valencia tienen los elementos del grupo 14? ¿Y los del grupo 17?
Como ya has visto, la posición de los elementos en la tabla periódica ayuda a conocer sus propiedades. Aquí puedes ver que el grupo en el que se encuentra el elemento refleja, entre otras cosas, el número de electrones en la capa de valencia.
Si el grupo 14 tiene 4 electrones de valencia y el grupo 17, 7 electrones de valencia, ¿podrías dibujar la estructura de Lewis del carbono y del flúor? El carbono con 4 puntos y el flúor con 7 puntos como se muestra en la imagen.
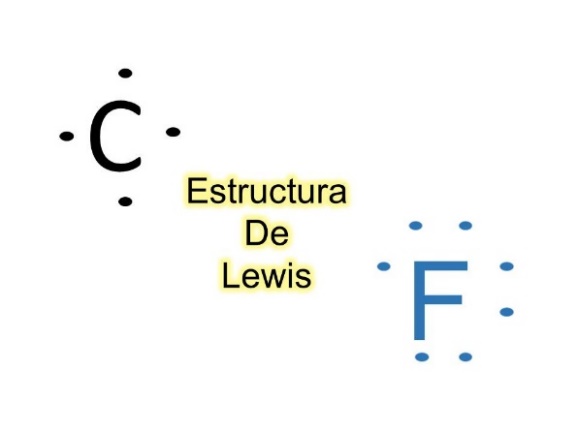
Dibuja la estructura de Lewis con el metano. La fórmula química es CH4, es decir que tiene un átomo de carbono y 4 átomos de hidrógeno, así es, el carbono tiene 4 electrones de valencia por estar en el grupo 14 de la tabla periódica y el hidrógeno, está en el grupo 1, tiene 1 electrón de valencia, dibuja cuatro átomos de hidrógeno con un su electrón respectivo a cada uno de ellos, ahora acomódalos cerca del carbono para formar pares de electrones.

Es muy importante entender cómo interactúa la materia para identificar su estructura, propiedades, y asimismo los riesgos para el medio ambiente y el hombre.
Conoce una tragedia que sucedió hace más de 80 años.
La tragedia del Zeppelin Hindenburg.
El 6 de mayo de 1937, el Hindenburg, orgullo de la flota de dirigibles de la Alemania nazi, estalló en llamas en el cielo de Nueva Jersey cuando iba a realizar las maniobras de ataque. Esta tragedia marcó el final de la era dorada de los zepelines.
El enorme zeppelín llegó a cruzar 17 veces el océano Atlántico, recorriendo más de 308.000 kilómetros.
El zeppelín Hindenburg surcó los cielos de Berlín durante la inauguración de los Juegos Olímpicos de 1936.
Una chispa prendió en el dirigible Hindenburg y en menos de un minuto cayó envuelto en fuego. De las 97 personas que viajaban en el Hindenburg, murieron 35, 13 pasajeros y 22 tripulantes. El accidente ocupó las portadas de los periódicos de la época.
¿Pero qué fue lo que ocasionó este trágico accidente?
El Zeppelin fue considerado un palacio flotante, compitiendo con el lujo del Titanic. Fue diseñado para contener un gas noble nombrado helio, pero aquel día su contenido no fue este gas sino otro, hidrógeno, el cual es muy reactivo dado que se une con otros átomos produciendo nuevos compuestos, se dice que los ingenieros alemanes decidieron emplear hidrógeno porque las reservas de helio estaban acaparadas.
Si el Zeppelin hubiese contenido el gas noble helio, aquel desastre no hubiera ocurrido dado que este elemento es muy poco reactivo con otros átomos, ya que su estructura es estable, de hecho, se le conoce también como un gas inerte por esta condición.
Observa la siguiente cápsula del minuto 03:00 al 04:45, que explica la estabilidad de los átomos:
- Átomos estables
Como pudiste observar en el video, en general, los átomos tienden a completar su capa más externa para que las moléculas sean estables.
Los elementos se encuentran en un determinado lugar dentro de la tabla periódica, indicando los electrones de valencia de su última capa o nivel de energía, pero sabían también que estos indican la cantidad de enlaces que pueden llegar a formar.
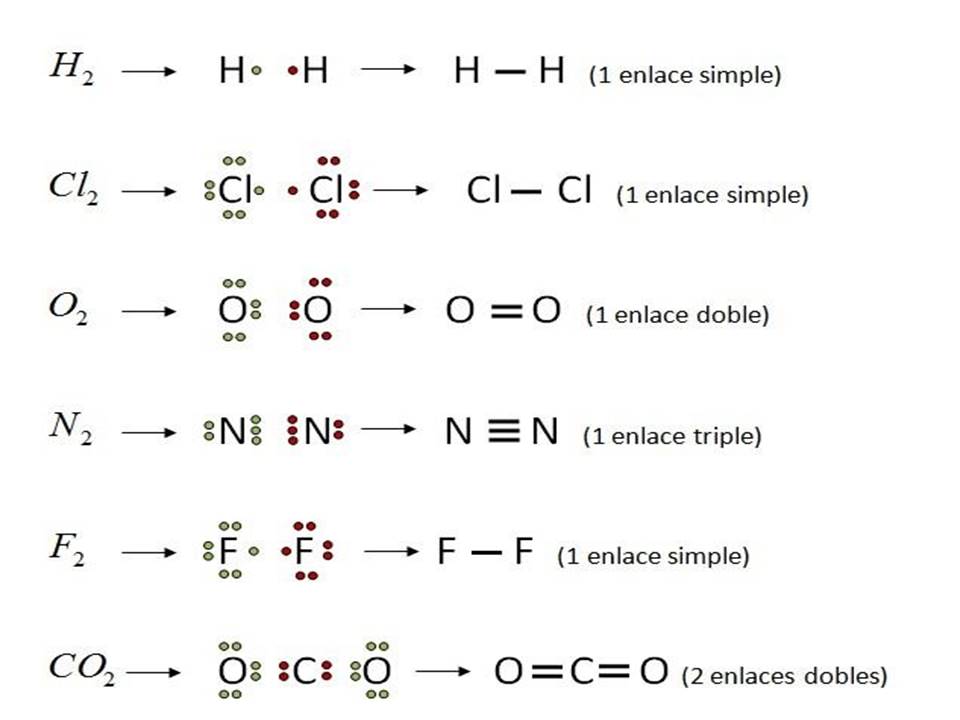
El hidrógeno, por ejemplo, sólo puede formar un enlace sencillo porque se encuentra en el grupo 1 de la tabla periódica. Se encuentra como una molécula diatómica, es decir, que se unen dos átomos de hidrógeno por medio de un par de electrones. Su unión se representa de la siguiente manera utilizando la estructura de Lewis.
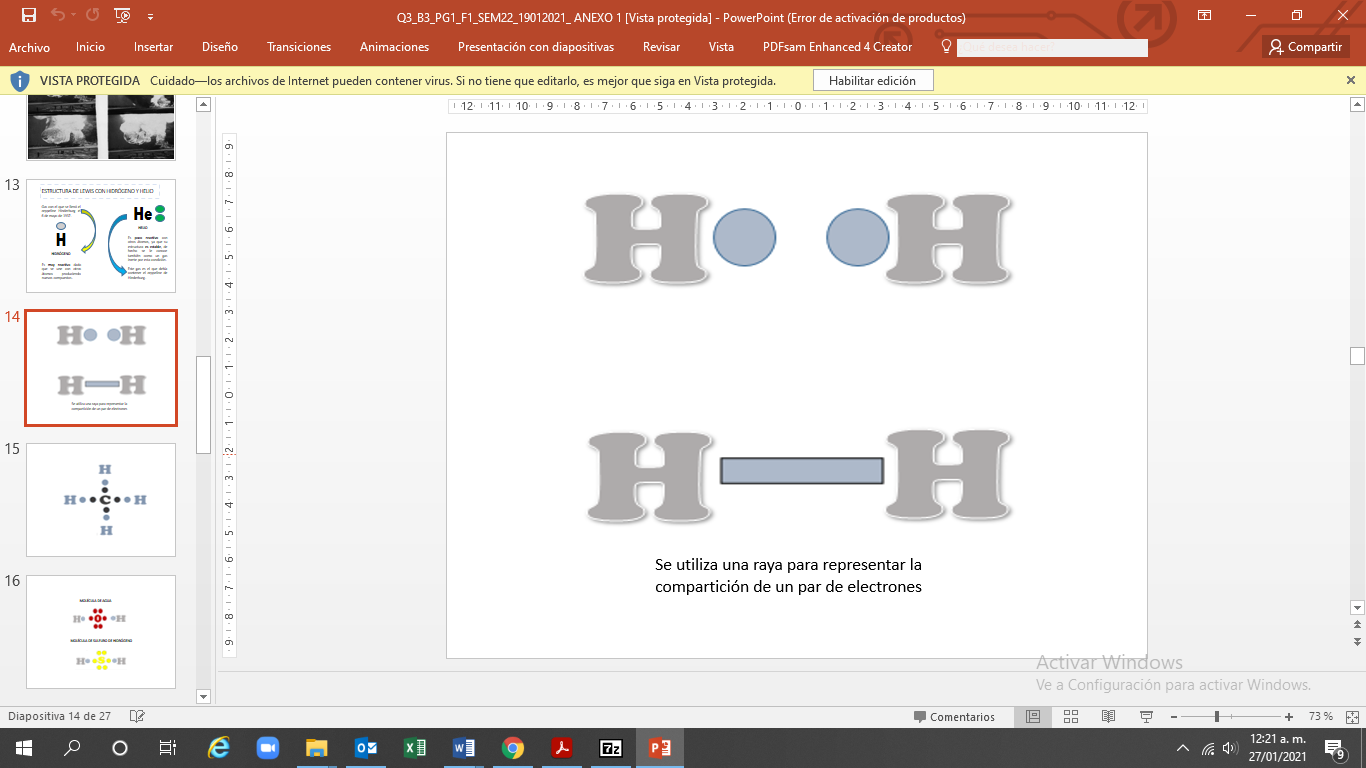
También se puede representar con una raya la compartición de un par de electrones.
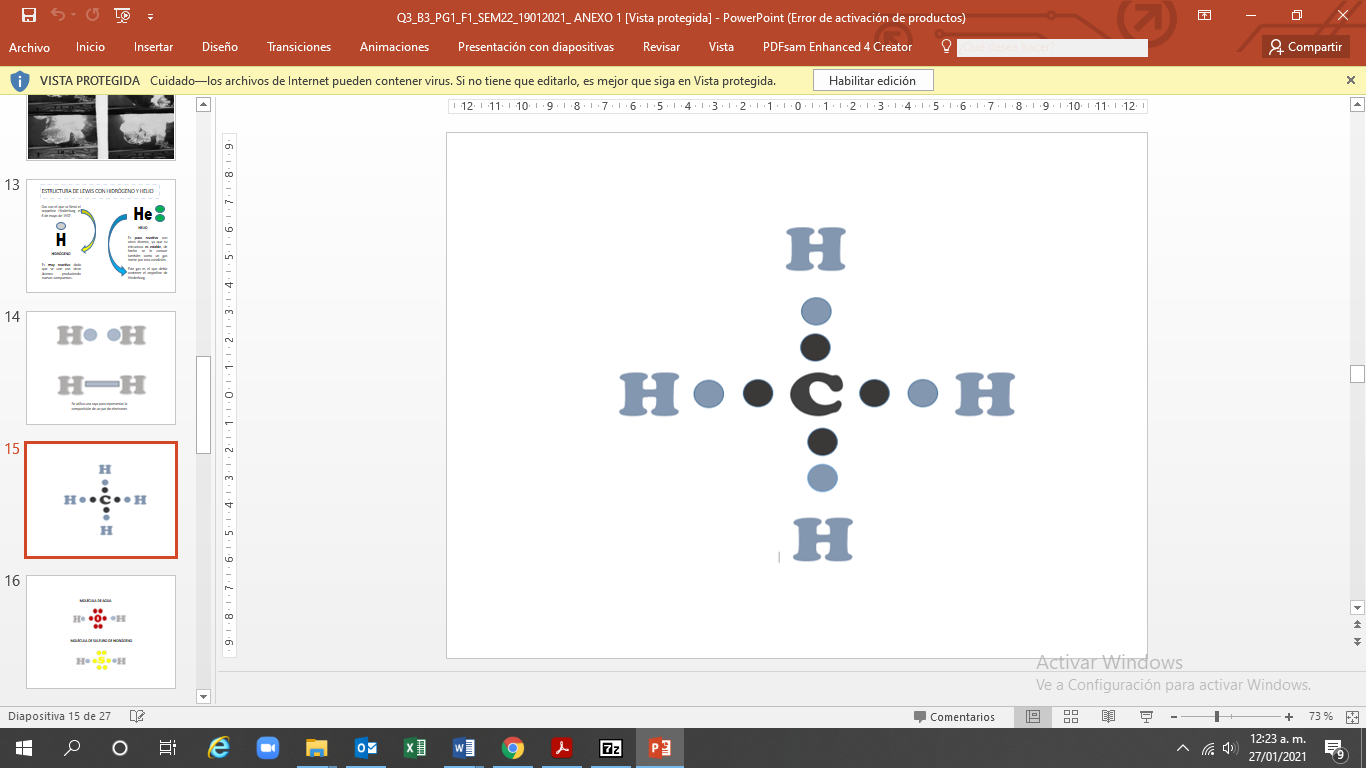
En el caso del carbono este elemento se encuentra en el grupo 14, por lo tanto, tiene 4 electrones de valencia e indica que puede formar cuatro enlaces.
Por ejemplo, cuando dibujaste el metano pudiste observar que cada átomo de hidrógeno logra hacer un enlace sencillo, mientras que el átomo de carbono es capaz de formar cuatro enlaces sencillos compartiendo sus 4 electrones de valencia.
¿Notas alguna similitud en las siguientes fórmulas químicas H2O, H2S?

Los átomos de estos compuestos se unen por medio de dos enlaces sencillos, el oxígeno y el azufre forman dos enlaces sencillos compartiendo dos de sus electrones para completar 8 en su capa de valencia.
Para representar una molécula con la estructura o diagrama de Lewis debes seguir ciertas reglas, las cuales son:
- Contar los electrones de valencia de todos los átomos de la molécula.

- Debes elegir el átomo central, buscando al que sea menos electronegativo. La excepción a esta regla es el hidrógeno, ya que éste sólo puede tener dos electrones rodeándolo.
- Dibujar al átomo central con sus electrones de valencia alrededor. Tomar en cuenta la carga, en el caso de tratarse de un ion.
- Dibujar el resto de los átomos rodeando al átomo central, con un electrón de valencia del átomo central emparejado con un electrón de valencia del átomo secundario.
- Contar el número de electrones alrededor de cada átomo. Éstos deben cumplir la regla del octeto, quiere decir que deben tener ocho electrones de valencia rodeándolos. Esta regla no aplica para el hidrógeno, litio y berilio, los que deben estar rodeados por dos electrones según la regla del octeto.
- No siempre se puede cumplir estas reglas con enlaces simples, es en estos casos que se van agregando enlaces dobles o triples a la molécula
La estructura o diagrama de Lewis es una representación que muestra los enlaces entre los átomos de una molécula, así como los pares de electrones solitarios, es decir aquellos que no forman parte del enlace.
Esta representación se usa para saber la cantidad de electrones de valencia de un elemento que interactúan con otros formando enlaces ya sea simples, dobles, o triples.
Ahora llevarás a cabo una actividad para aplicar el contenido.
Realiza un ejemplo para disipar dudas (usar símbolos y electrones hechos con hojas de color).
El dióxido de carbono CO2, se utiliza como agente extintor, ya que elimina el oxígeno encontrado en ese espacio, e impide que se genere una combustión. En la industria alimentaria se utiliza en bebidas carbonatadas para darles efervescencia.
El símbolo de Lewis del carbono se representa con una letra C mayúscula acompañada de 4 electrones de valencia.
Mientras que el oxígeno se representa con la letra mayúscula O acompañada de 6 electrones de valencia.
Recuerda que en una sesión anterior aprendiste cuáles son los colores con los que se representan los átomos, por eso el carbono está en negro y el oxígeno en rojo.
Ahora falta representar el diagrama de Lewis de la molécula, tienes que colocar al carbono en el centro y los dos oxígenos a un costado para que se pueda representar el enlace.
Posteriormente colocas los electrones de valencia al carbono, si revisas en la tabla periódica, observas que el carbono pertenece al grupo 14 y por lo tanto tiene 4 electrones de valencia, sitúa 2 del lado derecho y dos del lado izquierdo, después tienes que colocar los electrones de valencia de cada átomo de oxígeno, recordando que el oxígeno se encuentra en el grupo 16, deduce que tiene 6 electrones de valencia, para el primer átomo alinea 2 con los del carbono y los demás los sitúas en parte superior y de lado izquierdo, ahora haces el mismo procedimiento con el segundo átomo de oxígeno.
Para saber si el diagrama de Lewis está correcto tienes que contar los electrones, recuerda que se tiene que cumplir con la regla del octeto.
El primer oxígeno forma un enlace doble con el carbono, por lo tanto, están compartiendo dos pares de electrones, si los sumas, sabrás que son 4 más 2 de la parte superior, van 6 y dos más que están de lado izquierdo, efectivamente tiene 8 electrones de valencia. Continua con el carbono, este átomo se encuentra compartiendo 2 pares de electrones con cada oxígeno, si sumas 4 más otros 4 son los 8 electrones de valencia que debe tener. Ahora sumas los electrones del segundo átomo de oxígeno 4 de dos pares de electrones que comparte con el átomo de carbono más 2 de la parte superior más 2 del lado derecho suman 8.
Esta molécula es estable porque las capas de valencia de los átomos que la forman están completas con sus 8 electrones.
Ahora comprueba lo aprendido a través del siguiente ejercicio:
Representa en tu cuaderno el diagrama de Lewis de las siguientes moléculas utilizando una tabla como se ejemplifica. En ella tienes que escribir molécula, uso común, los símbolos y el diagrama de Lewis. Las moléculas son amoniaco, acetona y agua.

Si tienes alguna duda puedes consultar con tu maestro.
Se te sugiere consultar la siguiente página electrónica donde encontrarás actividades interactivas que puedes trabajar con tu maestro o maestra para aprender jugando a través de esta plataforma.
http://www.objetos.unam.mx/quimica/simbolosLewis/index.html
¿Sabías qué? El carbono es un elemento químico que puede formar muchos compuestos al unirse con más carbonos y algunos otros elementos. Asimismo, el carbono en estado sólido, puede adoptar muchas formas alotrópicas, por ejemplo, más baratos el carbón; más blandos el grafito; más caros y a la vez más duros el diamante. El grafeno forma láminas onduladas del grosor de un átomo (0.1 nm), con una resistencia y conductividad eléctrica excepcionales.
Tanto el carbón, el grafito, el grafeno y el diamante, están formados solo por átomos de carbono. La diferencia está en la estructura cristalina de cada uno, que a su vez se debe al tipo de enlaces que forma.
Actualmente si tienes que salir, al volver a casa o entrar a un lugar pisas una disolución de agua con cloro, que por cierto no es cloro, pues el cloro en su estado natural es un gas de color amarillo limón, sino Hipoclorito de sodio NaClO ¿por qué o para qué se hace? En principio, este hábito podría ayudar a disminuir los microorganismos patógenos en la suela de los zapatos, ya que el hipoclorito de sodio actúa sobre los microorganismos a nivel celular, rompiendo la estabilidad de los enlaces que conforman la membrana del microorganismo, ocasionando su muerte. Este es solo un ejemplo de cómo la química se encuentra en la vida cotidiana.
Aunque fue nominado 42 veces, Lewis nunca ganó el Premio Nobel de Química.
Durante esta sesión aprendiste sobre los trabajos de Lewis y te encontraste que lo planteado por él tiene alcances, pero también limitaciones, y por ello las conocerás para concluir con este tema.
Entre las aportaciones encuentras:
- El modelo de Lewis representa los electrones de valencia del átomo.
- La regla del octeto identifica la cantidad de electrones necesarios para que un átomo complete su capa de valencia de 8 electrones.
- El modelo de par electrónico permite identificar cómo se forma el enlace covalente.
Las limitaciones son: - El modelo de Lewis no proporciona información sobre el tipo de enlace entre átomos, los electrones no se encuentran en los vértices de un cubo y los electrones no están inmóviles.
- La regla del octeto no aporta información acerca el tipo de enlace que se forma entre los átomos para completar su capa de valencia.
- El par electrónico no explica la formación de los enlaces iónicos.
El reto de hoy:
Se te recomienda que visites la siguiente liga donde encontrarás información de la Doctora Katharine Blodgett, quien trabajó al lado de Langmuir y estudió su doctorado en el laboratorio Cavendish de la Universidad de Cambrige, Universidad en la que Rutherford realizaba sus investigaciones.
https://mujeresconciencia.com/2018/11/13/katharine-burr-blodgett-1898-1979/
¡Buen trabajo!
Gracias por tu esfuerzo.
Para saber más:
Lecturas



Login to join the discussion