Semana de la ciencia
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:12
Semana de la ciencia
Aprendizaje esperado: a partir de situaciones problemáticas, plantea premisas, supuestos y alternativas de solución, considerando las propiedades de los materiales o la conservación de la masa.
Énfasis: plantear situaciones de la vida cotidiana a fin de analizar propiedades y transformaciones de los materiales.
¿Qué vamos a aprender?
En esta ocasión se inicia con la Semana de la Ciencia.
Se realizarán actividades muy variadas: juegos didácticos, entrevistas a personalidades, actividades experimentales, entre otras.
Lee la siguiente frase célebre de Carl Sagan:
“La ciencia es más un modo de pensamiento que un cuerpo de conocimientos. Su objetivo es averiguar el funcionamiento del mundo, buscar las posibles regularidades, comprender las relaciones que existen entre las cosas, desde las partículas subnucleares, que pueden ser los componentes de toda la materia, hasta los organismos vivos, la sociedad humana y, por último, la totalidad del cosmos...”.
¿Te gustan las piedras preciosas? Las piedras preciosas están formadas de cristales, éstos tienen particulares arreglos espaciales que se deben a enlaces iónicos o covalentes. Mientras que el color propio de los cristales se debe a impurezas de ciertos elementos químicos.
Como has aprendido a lo largo de las sesiones, la Química está presente en todas partes, y la joyería no es la excepción. Abordarás acerca de la relación de los elementos con el color de las piedras preciosas y no tan preciosas.
Las piedras preciosas son sustancias minerales que, por sus propiedades físicas como: dureza, transparencia, brillo, índice de refracción y por hallarse raramente en la naturaleza, tienen un gran valor comercial. Casi todas las piedras preciosas, a excepción del diamante, están compuestas principalmente de silicio, el mineral presente en mayor cantidad en la corteza terrestre (26%).
Un mineral es un compuesto químico natural, generalmente de forma cristalina. Tiene una composición química específica y deben su color a pequeñas cantidades de impurezas, que son usualmente metales, como el hierro, el cromo, el cobre, el vanadio y el manganeso.
Existe una gran variedad de minerales, sin embargo, sólo cuatro se consideran gemas preciosas. Para ver el lado bello de la química, vas a saber más de ellas y de cómo, dependiendo de los elementos presentes en la piedra preciosa, será su coloración.
¿Qué hacemos?
El diamante debe su nombre al griego "adamas", que significa indomable. Es la única piedra preciosa formada por un sólo elemento: el carbono C, sí, el elemento químico que también constituye una parte importante del organismo.
Existen dos formas en las que el carbono se presenta en la naturaleza, a estas se les llama formas alotrópicas y son el grafito y el diamante.

Sería lógico pensar que el cristal de diamante, al estar compuesto por el mismo elemento químico que el grafito común, tuviese la misma estructura, pero lo que los distingue es la forma en que se disponen los enlaces químicos que unen a estos átomos de carbono. Estos átomos están vinculados los unos a los otros por medio de “enlaces covalentes”.
En el caso del diamante, estos enlaces covalentes y cada centro de estos átomos de carbono está distanciado de su vecino solamente por una distancia de 0.000 000 154 milímetros, esto quiere decir que los enlaces atómicos del diamante son muy cortos, esto explica en parte su gran dureza.
En el caso del grafito sus átomos de carbono están más separados, lo cual lo hace frágil y blando.
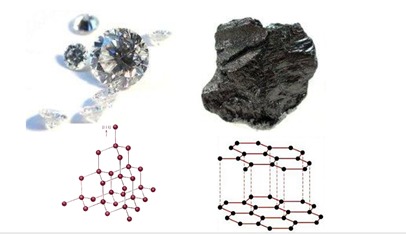
La dureza de los minerales se mide en una escala que va del 1 al 10, la escala de Mohs, de acuerdo con esta escala el diamante tiene una dureza de 10, lo cual lo hace uno de los materiales más duros que existen.
Ahora, conoce dos piedras preciosas formadas del mismo mineral, el corindón. El corindón es un óxido de aluminio cuya fórmula química es Al2O3, es un mineral incoloro, pero la presencia de ciertos elementos químicos le dan una coloración característica, tal es el caso del rubí y el zafiro.

El rubí es un mineral de color rojizo. Debe su color a los metales de hierro y cromo con los que está asociada esta variedad de corindón. Su nombre "ruber", significa "rojo" en latín. Le corresponde la dureza 9 en la escala de Mohs. Junto al zafiro, la esmeralda y el diamante, el rubí es considerado una de las cuatro gemas preciosas.

Los corindones que tienen color o tonalidades en azul, se denominan zafiros. Estos zafiros igualmente conservan todas sus propiedades físicas y químicas distintivas, sin embargo, son de color azul debido a impurezas de hierro y titanio en su red cristalina. El zafiro es la piedra preciosa azul más valiosa y muy deseada debido a su color.

La esmeralda es la variedad color verde de un silicato de berilio y debe su color al óxido de cromo y en algunas ocasiones al vanadio. La esmeralda es una de las piedras preciosas más hermosas y de más valor tiene una dureza que se acerca a 8 en la escala de Mohs. Su nombre, posiblemente de origen persa, significa piedra verde y su verde es tan especial que, en su honor, se le denomina verde esmeralda.

La Aguamarina es la variedad color verde mar de este mismo compuesto del berilio, pero debe su color al elemento hierro.

Se denomina cuarzo a la variedad de compuestos de óxido de silicio. Es un mineral muy abundante y se presenta en numerosas variedades. En el caso del cuarzo, la presencia de otros minerales le proporcionan un efecto especial, por ejemplo:

•La amatista es la variedad violeta del cuarzo, teñido por el óxido de manganeso.
•El jade, en sus distintas variedades, fue utilizado en Mesoamérica por las culturas precolombinas. Sus coloraciones verdes se deben a impurezas de combinaciones como: sodio y aluminio para la jadeíta y calcio y magnesio como la nefrita.
Para terminar, realizarás cristales. Un cristal es la forma poliédrica regular, limitada por caras lisas, que adquiere un compuesto químico bajo la influencia de sus fuerzas interatómicas. Este proceso ocurre cuando el compuesto químico pasa, en condiciones apropiadas, del estado líquido o gaseoso al sólido.
Para esta actividad necesitaras:
- Sulfato de cobre
- Agua caliente
- 2 vasos de precipitado
- Papel filtro
- Embudo de filtración
- Un trozo de estambre
- Pinzas
Prepara una disolución sobresaturada de sulfato de cobre disolviendo 150 g en 200 ml de agua. Calienta para disolver todo el compuesto, filtra para eliminar cualquier impureza, deja enfriar lentamente colocando un pedazo de estambre dentro de la disolución.
Al paso de algunos días obtendrás un cristal. Realiza lo mismo en tu casa con sal común o con alumbre y obtendrás algunas estructuras cristalinas.
Realiza una visita al Museo Virtual de Geología en el siguiente enlace, para que conozcas más sobre este tema:
https://www.sgm.gob.mx/Web/MuseoVirtual/inicio.html
La siguiente Historia de un compuesto escrita en 1995 por Rocío Trujillo Ortiz, quien estudió en el CECyT núm. 13, Ricardo Flores Magón, del Instituto Politécnico Nacional.
- Historia de un compuesto
Date oportunidad de hacer Arte con Química y Química con Arte, seguramente será algo maravilloso.
Como última actividad te invitamos a jugar La ciencia es divertida.
Dimitri Mendeleiev creó unas fichas en las que dibujó símbolos químicos y se le ocurrió clasificarlos atendiendo a ciertas propiedades, del mismo modo como se hace cuando uno juega solitario con una baraja de cartas. Por eso, como el juego es un método genial lo vas a utilizar para acercar a todos al extraordinario mundo de la química.
Para el estudio de la química es necesario conocer su lenguaje, el cual tiene símbolos. Los símbolos que debes reconocer son los que se encuentran en la Tabla Periódica de los Elementos Químicos.
Iniciaras con un juego de memoria, el memorama químico con el grupo de los elementos representativos.
En el juego hay 100 tarjetas, de las cuales 50 pertenecen a los símbolos de elementos y 50 a los nombres de los elementos. Las tarjetas se colocan en desorden, en el lado derecho los símbolos y del lado izquierdo los nombres.
No se debe ver los símbolos y nombres, ahora debes comenzar volteando una tarjeta del lado de los símbolos y otra del lado de los nombres para encontrar el par, si no se consigue se deben voltear y volver a buscar los pares. Se puede jugar de 1 hasta 10 personas.
Si no se encuentran los pares se debe cambiar de turno para participar, pero si una persona localiza un par puede voltear otras tarjetas hasta que no encuentre el par y así cambiar de turno.
El que consiga el mayor número de pares gana el juego, y gana Conocimiento y aprendizaje sobre los elementos químicos de la Tabla Periódica.
Otro juego que puedes utilizar para aprender el lenguaje químico es la lotería de los elementos, para ello se necesitan 12 tableros que tienen 16 símbolos de los elementos químicos o de moléculas que se has estudiado, también se necesitan 55 tarjetas con los nombres de los elementos químicos y moléculas.
Para iniciar el juego se requiere una persona que maneje las tarjetas y de 2 hasta 12 personas que jueguen con los tableros.
Se pueden utilizar fichas, semillas, tapas de bebidas o lo que se tenga a la mano para identificar los elementos en los tableros que se mencionan con las fichas. La primera persona que marque todo el tablero debe gritar ¡Logrado!
Inventa tu propio juego, acércate a tu familia, seguro te parecerá interesante.
Puedes darte cuenta de que en la sesión se trató conocimientos que ya adquiriste en sesiones anteriores, como propiedades de los elementos, enlaces químicos, elementos representativos de la tabla periódica y se mencionó lo relativo a la Ley de la conservación de la materia.
Es conocido que la materia está formada por átomos, iones o moléculas, que en ocasiones se agrupan para formar lo que se conoce con el nombre de compuestos. Históricamente, estos agregados (atómicos, iónicos o moleculares) se han clasificado en los tres estados fundamentales de la materia: gas, líquido y sólido. Pues bien, el denominado estado cristalino corresponde fundamentalmente al estado sólido, pero con propiedades muy especiales.

La materia se considera estrictamente cristalina si los átomos, iones o moléculas que la componen se distribuyen en las tres direcciones independientes del espacio de un modo regular y repetitivo, y a esta forma de materia se denomina cristal, que los antiguos griegos identificaron con el mineral cuarzo.
Los cristales suelen evidenciar su orden interno por la aparición de morfologías externas regulares, es decir, caras y aristas reconocibles.
Aunque generalmente el concepto de cristal se asocia con el estado sólido que muestran los minerales, las moléculas biológicas, como las proteínas, dan lugar a cristales extremadamente frágiles, con contenidos de agua que llegan hasta el 80% del volumen del cristal, representando un ambiente más próximo al estado líquido que al sólido, pero que en general mantienen una morfología que evidencia su orden interno.
En otro sentido el estado cristalino puede considerarse también como un límite de la evolución del estado líquido hacia el sólido.
El reto de hoy:
Para saber más acerca de la química y el arte lee el siguiente libro que pertenece a la colección de la Biblioteca Escolar. Serie Espejo de Urania.
La química en el arte
Autor: García, Horacio
Publicación: México, SEP: ADN.
También lee: Poesía Química
Recopilación de María Mendoza Cruz
Lo puedes encontrar en la dirección electrónica:
https://bibliotecavirtual.diba.cat/documents/10934/2694863/document1.pdf
Para saber más acerca de los cristales, en la dirección electrónica:
https://www.xtal.iqfr.csic.es/Cristalografia/parte_01.html
¡Buen trabajo!
Gracias por tu esfuerzo.



Login to join the discussion