¿Cómo evitar la corrosión?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:12Aprendizaje esperado: propone preguntas y alternativas de solución a situaciones problemáticas planteadas con el fin de tomar decisiones relacionadas con el desarrollo sustentable.
Énfasis: proponer preguntas y alternativas de solución a situaciones problemáticas planteadas con el fin de tomar decisiones relacionadas con el desarrollo sustentable.
¿Qué vamos a aprender?
Lee la siguiente frase célebre:
“Cuando más debes de luchar, es cuando estás cerca de la meta”
Estas son palabras de Rodolfo Neri Vela, el primer astronauta mexicano en alcanzar las estrellas.
En esta sesión trabajarás en el proyecto titulado: ¿Cómo evitar la corrosión?
El propósito es proponer preguntas y alternativas de solución a una situación problemática y con ello tomar decisiones que estén relacionadas con el desarrollo sustentable.
Los materiales que necesitarás es tu cuaderno, tu libro de texto, lápiz, colores y bolígrafo.
NOTA para el docente.
Se te propone que guíes a tus estudiantes acerca de las inquietudes que pueden originarse, tanto en esta sesión como en otras, mediante el uso de la siguiente herramienta didáctica: La estrategia de V de Gowin.
¿Qué hacemos?
¿Sabes de qué están hechas las naves espaciales? Puedes pensar que en su diseño se debe considerar una estructura capaz de resistir aceleraciones, variaciones de temperatura e impacto de los micro meteoritos, entre muchos otros factores.
Imagina de que materiales están hechas. ¿Metales? ¿Cerámicas? ¿Plásticos? ¿Crees que estas estructuras resistan el mismo tipo de daño o alteraciones en la Tierra que en el espacio? Anota tu respuesta.
Con la información que ya tienes sobre algunos materiales, deduce cuáles podrían ser los más apropiados.
Lee los comentarios de algunas alumnas:
Alumna 1: Ahora que las estoy viendo, yo pienso que no es conveniente que las naves espaciales sean de plástico porque este material, al someterlo a altas temperaturas, se derrite. Por eso creo que lo mejor sería de metal.
Alumna 2: No creo que sean de metal, ya que hemos observado que en la Tierra se llegan a picar. En fin, no sé si en el espacio existen las mismas condiciones que en la Tierra y que permitan la alteración de los metales.
Alumna 3: He descubierto varios factores que provocan que el metal acá en la Tierra se esté deshaciendo ¡Y yo que pensaba que tenían demasiada dureza! Sin embargo, desconozco las condiciones que hay en el espacio.
Sería conveniente que nos ayudaran a investigar cuál es el factor causante de que los metales se vuelvan tan frágiles aquí en la Tierra, para después indagar si se presentan las mismas condiciones que en el espacio.
Es un misterio que debes resolver. Te convertirás en un detective químico.
Los detectives son personas que estudian hechos y fenómenos. Recordando a ese famoso personaje inglés que utilizaba técnicas, formulaba hipótesis, hacía observaciones e implementaba experimentaciones para comprobar sus hipótesis.
Dicho personaje, analizaba la información experimental como la documental y por último daba a conocer sus resultados. Es decir, era un investigador, y hacía de cada misterio, un proyecto y resolvía algunos misterios.
Ahora tu investigarás cuál es el factor causante de las alteraciones en los metales, que también resulta en grandes pérdidas económicas. Además, averiguarás qué se puede hacer para frenarlo, y se propondrán alternativas de solución a este grave problema.
Este es el caso:
¿Cuál es el factor que causa el deterioro del metal?
¿Cómo se puede detener su ataque?
Si tienes más preguntas formúlalas. Si recuerdas bien a este personaje, tal vez también recuerdes que trabajaba en equipo, tú también puedes trabajar de manera colaborativa.
Tal y como lo haría un detective, observa las evidencias químicas.
Este es un metal de la fachada de una casa, al acercarte puedes darte cuenta que se volvió peligroso.

Observa el cesto de basura que es de metal.

Ésta otra es en Veracruz, en una plataforma petrolera.

Ésta es de una cortina de metal, observa también la maceta, hecha de una cubeta de metal.

Pero, son lugares tan diferentes y distantes ¿Eso no es por acción del ser humano, o sí?
¿Qué factor consideras que es el causante?
Formula una hipótesis con base en lo que conoces.
¿Cuál o cuáles crees que serán los propósitos de investigar todo esto? ¿Para qué te va a servir?
También debes contar con un cronograma de actividades donde asignarás roles de participación de los integrantes y fechas de entrega del plan de acción.
Es preciso diversificar las actividades y considerar la información documental, experimental y de campo.
También es importante definir el medio en el que se va a compartir la información -de acuerdo a los recursos disponibles- y tener presente a quién estará dirigida la información.
Es fundamental que cada proceso tenga una evaluación. No sólo se trata de aplicar un examen, sino de evaluar si tu proceso fue adecuado o debes plantearlo de otra manera.
Es momento de saber si otras personas han realizado antes alguna investigación acerca del caso.
Revisando bibliografía seguramente has dado con el villano de esta historia, y no se trata de ninguna persona, sino de un proceso químico muy conocido.
¿Cómo es eso posible? Si los metales como los conoces, con forma, textura y función no aparecieron así por arte de magia.
Estos metales tuvieron que pasar por un proceso de manufactura de las materias primas, y por ahí comenzarás.
Desde el principio del ciclo, los metales forman parte de la naturaleza y de la corteza terrestre.
Se les encuentra como minerales, mayoritariamente como óxidos y otras sales, como sulfuros, cloruros, sulfatos o carbonatos. Seguro lo recuerdas de sesiones pasadas.
El proceso principal para obtener estos metales es la metalurgia.
Que, por cierto, son procesos complejos y costosos ya que emplean grandes cantidades de energía.
¿Qué ejemplos de minerales se te ocurren?
Hematita (Fe2O3), Magnetita (Fe3O4), Limonita FeO (OH)∙H2O, Siderita (FeCO3), Pirita (FeS2), entre otros.
Estos son ejemplos de minerales de los cuales se podría extraer el hierro, a partir de este proceso metalúrgico.
¿Por qué el hierro se encuentra formando óxidos? ¿Por qué no se produce de forma libre en la naturaleza? ¿Crees que los óxidos de hierro son más estables que el hierro en su forma libre?
Como lo puedes imaginar, los minerales presentes en la naturaleza son más estables que el metal en su estado elemental, en consecuencia, tarde o temprano el metal regresa a su forma más estable.
Esto quiere decir que el ciclo que se inició con el mineral a partir del que se extrajo el metal, termina cerrándose cuando el metal se corroe, y vuelve a transformarse, por ejemplo, en óxido.
El proceso al que se refiere se llama corrosión.
La corrosión es un proceso químico, a través del cual un metal o una aleación pasa de estar en su estado elemental a otro estado en el que comúnmente forma parte un óxido.

Un átomo está formado por tres tipos de partículas subatómicas: electrones, protones y neutrones.
Para que un metal se oxide es necesario que los átomos que lo constituyen pierdan electrones. Cuando los átomos de un elemento ceden uno o más electrones, se convierten en átomos cargados positivamente, y se les denomina cationes.
Los cationes pueden dispersarse en el entorno o pasar a ser parte de la capa de óxido. Los electrones juegan un papel clave, por lo que la corrosión se clasifica como un proceso electroquímico.
Los electrones no pueden acumularse en la superficie del metal. Siempre que el metal se oxida, es necesario que haya disponible otra especie química que acepte esos electrones; el agente oxidante.
Cuando el material metálico entra en contacto con el aire y con cierto grado de humedad, es el oxígeno del aire el que lleva acabo este proceso químico al ganar electrones. El oxígeno, al reaccionar con los iones de hidrógeno y los electrones pasa por una transformación química, y como resultado, se convierte en agua.
¿Por qué es importante conocer la corrosión?
Sigue buscando más pistas-evidencias.
Observa esta muestra de un auto.

Está hecho de acero, una aleación de hierro con carbono.
Todo este desastre comenzó con un pequeño rayoncito en el mercado. Al poco tiempo aparecieron unas manchitas, y luego pequeños agujeros alrededor de la pintura saltada.
Luego, la situación empeoró, lo llevaron a Veracruz, lo estacionaron cerca de la playa en ese ambiente marino. Estuvo lloviendo por mucho tiempo, y además lo estacionaron cerca de un área industrial donde se descubrió que había lluvia ácida. Ahora está así, y le tendrán que dar un mantenimiento mayor.
A principios del siglo XIX India era parte del imperio británico, por lo que los enemigos del ejército británico no eran propiamente los hindúes. Los cartuchos explotaban por sí solos estando dentro del arma.
Al ser examinados, se observaron pequeñas fisuras en los cartuchos, que eran consecuencia de procesos de corrosión.
Se descubrió que existía una relación entre la velocidad con las que aparecían las fisuras y la época del año.
El problema aumentaba en los meses del monzón, cuando la humedad y la temperatura suelen ser altas. Sin embargo, las fisuras no se hubieran iniciado de no haberse guardado las municiones en establos, donde el aire estaba saturado de amoníaco, a causa de la evaporación de la orina de ratas y el estiércol del ganado.
Existen metales que no se deterioran por la corrosión, un ejemplo de ellos es el oro.
A los metales que difícilmente se corroen, se les conoce como metales nobles.
Sólo se deterioran cuando entran en contacto con agentes químicos muy específicos que pueden ser: Temperaturas elevadas, altas concentraciones, o porque son particularmente agresivos.
Otros metales de esta familia son el platino, el iridio y el paladio, entre otros. Estos metales se encuentran en la naturaleza en su forma elemental, es decir, que no se requieren complejos procesos metalúrgicos para extraerlos de su mina o del mineral que los contiene.
Sin embargo, son poco abundantes en la corteza terrestre, lo que hace que su precio sea elevado.
Se les conoce también como metales preciosos, y son frecuentemente empleados en joyería y orfebrería, precisamente por su capacidad de permanecer prácticamente inalterables con el paso de tiempo.
Existen varias formas de saber qué metal o aleación se va a corroer con mayor facilidad. Una aproximación puede obtenerse a partir de una lista de materiales que se denomina serie galvánica, como la que se muestra en la siguiente tabla.

Ordena a los metales y ubica arriba los que tienen menos facilidad para oxidarse (los metales menos reactivos o nobles) y abajo a los metales más reactivos.
Esta tabla te sirve para estimar cuál de ellos se atacará primero. Por ejemplo, en una pieza de hierro o acero en contacto con magnesio en agua salada, el magnesio se oxidará primero por ser más reactivo y cuando se agote se atacará el hierro.
También es la base de una de las formas más conocidas de enfrentarse a la corrosión. Mientras haya magnesio en contacto con el hierro, éste no se verá afectado por la corrosión. Así, los metales más reactivos, los ubicados más abajo en la tabla, protegen a los menos reactivos.
Este es el fundamento de un método conocido como protección catódica por ánodo de sacrificio.
¿Quiénes son los cómplices de la corrosión? No solo se requiere un metal, el proceso es más complejo y requiere de la participación de tres cómplices para poder iniciarse y avanzar:
Se necesita, por supuesto, el metal. Si está en la parte inferior de la tabla, mejor.
Por ejemplo, las láminas galvanizadas de un techo; es acero recubierto con cinc.
Para que el cinc se corroa, los átomos neutros que lo componen deben perder electrones, abandonar su forma elemental y convertirse en átomos con carga neta (iones).
Para conseguir una configuración que minimice su energía y los haga más estables, los átomos pueden perder uno o más electrones dependiendo de cómo están acomodados los electrones en el átomo neutro. Como al perder electrones los iones quedan con carga positiva, se les denomina catión.
Emplea el lenguaje simbólico de la química, esta etapa se representaría de la siguiente manera:
átomo → catión + electrones
Por ejemplo: Zn → Zn2+ + 2e-
A este proceso se le conoce como oxidación.
Debido a que los electrones no pueden acumularse en la estructura del metal, requieren de una sustancia que sea capaz de captar esos electrones liberados, el segundo cómplice es, el metal que está en contacto con aire o con algún medio líquido que contenga aire disuelto.
En estos casos, es el oxígeno presente en el aire quien cumple la función de captar los electrones y al reaccionar con el hidrógeno se transforma en agua. Recurriendo nuevamente a los símbolos químicos, el proceso quedaría representado así:
oxígeno molecular + protones + electrones → agua
O2 + 4 H+ + 4 e- → 2 H2O
A la etapa en la que los átomos de un elemento aceptan electrones, se le denomina reducción.
Busca al tercer cómplice.
Una conexión de aluminio de buen grosor. Esta conexión pertenece a una tubería transportadora de agua.
Su superficie es un área lisa, con dureza como todos los metales, pero podrían tener hundimientos, y espacios cacarizos, coloquialmente se dice que se está picando.
El Aluminio que se encuentra en la zona inferior de la tabla galvánica es muy reactivo.
Un metal y un entorno aireado tampoco son suficientes para que el proceso de corrosión avance, por lo que se necesita de un tercer cómplice, que es por cierto abundante y lo puedes encontrar en el aire, el cual varía sus proporciones dependiendo de la zona en que se encuentre, se refiere al agua.
La puedes encontrar en forma líquida o como vapor de agua. Posee la capacidad de disolver los iones que se producen, permitiendo que se alejen del sitio en que se forman. La presencia de agua hace posible que los iones se muevan y así se cierra también el circuito de cargas positivas que se producen en la oxidación y los electrones que se transfieren en la reducción.
Y no se requieren de grandes cantidades de agua, basta una pizca de humedad en el ambiente para que la lista de cómplices necesarios esté presente y se inicie la corrosión. En este proceso, los tres son imprescindibles, por lo que, si faltara cualquiera de ellos, no se iniciaría el proceso de corrosión.
¿Sabías qué? Las bacterias son microorganismos y algunas de ellas son participantes estelares en los procesos de corrosión.
El 9 de agosto de 2000 hubo una explosión en un gasoducto de Nuevo México (EE.UU.). Un gasoducto es una enorme tubería de acero empleada para transportar gases combustibles.
La causa fue un importante problema de corrosión en la pared del gasoducto.
Muchas bacterias producen ácidos como resultado de su proceso respiratorio. Las bacterias sulfato reductoras son particularmente agresivas, ya que generan ácido sulfhídrico, este compuesto es especialmente dañino para la mayoría de los aceros.
A este tipo de corrosión se le conoce como corrosión microbiológica o corrosión inducida por microorganismos.
Ahora que conoces al agresor de los metales, observa qué ha hecho el ser humano para protegerlos.
Los métodos que se aplican para proteger a los metales de la corrosión se basan en impedir la acción de alguno de los tres participantes que ya conociste. Por ejemplo:
Si es un medio líquido, se puede colocar aceite en vez de agua, ya que los iones no podrán disolverse. Como sabes, en muchos talleres mecánicos, los metales se conservan libres de óxido por más tiempo, si se les cubre con una capa de aceite o grasa.
Así funcionan algunos recubrimientos anticorrosivos. Una película de pintura sobre un metal puede actuar como una barrera física, impidiendo el contacto directo entre el metal y el oxígeno del aire.
Para que esto sea eficiente, hay que tener cuidado con las imperfecciones, defectos o poros en las estructuras metálicas, ya que el oxígeno es un gas y las pequeñas moléculas pueden atravesar cualquier resquicio que haya quedado sin recubrir.
Observa el mapa.
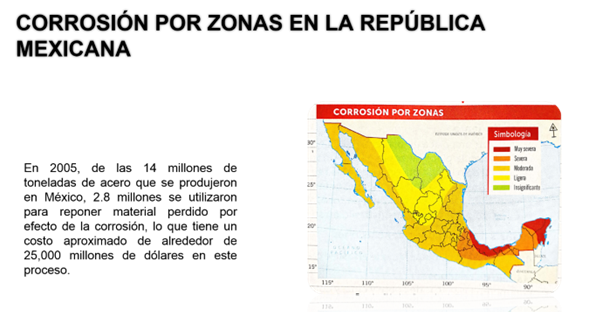
En 2005, de los 14 millones de toneladas de acero que se produjeron en México, 2.8 millones se utilizaron para reponer material perdido por efecto de la corrosión, cuyo proceso tiene un costo aproximado de alrededor de 25,000 millones de dólares.
¿Cómo explicarías las diferencias y similitudes en los niveles de corrosión que se observan en el mapa?
Por lo anteriormente presentado, se debe atender este fenómeno químico.
El 28 de abril de 1988, un Boeing 737 sufrió un accidente catastrófico al perder parte del fuselaje en pleno vuelo.
En las investigaciones, se determinó como causa la falta de mantenimiento, que no detectó la corrosión en el fuselaje.
No obstante, en 1981 otro avión sufrió los mismos daños, dejando un centenar de víctimas.
En Guadalajara, México, en 1992, una secuencia de explosiones de gasolina en el sistema de alcantarillado destruyó 12 kilómetros de calles, fallecieron 206 personas, casi 500 resultaron heridas y unas 15,000 quedaron sin hogar.
Algunas tuberías de drenaje habían sido remplazadas por tubos de cobre revestido de cinc, ubicados cerca de una tubería de acero de una abastecedora de gasolina. La humedad de la tierra hizo que los metales sufrieran corrosión galvánica, por lo que se filtró el combustible al subsuelo.
La acumulación de vapores y una chispa como detonante, provocaron la tragedia.
Con base en lo que ahora conoces de este proceso químico, responde:
¿Qué se requiere para que exista la corrosión?
¿Qué condiciones favorecen que se lleve a cabo este fenómeno?
Reflexiona y propone las medidas de prevención ante este fenómeno químico.
¿Cómo lo puedes detener?
Recuerda que una parte importante de los proyectos es dar a conocer los resultados de sus investigaciones.
¿Cómo piensas presentar o dar a conocer los resultados de su proyecto?
Podría ser que elabores un video donde propongas las medidas que se deberán aplicar para evitar la corrosión. No olviden indagar de qué materiales están hechas las naves espaciales, y reflexiona: ¿La corrosión se podrá dar en el espacio?
El reto de hoy:
Recuerda que la corrosión forma parte de las reacciones de óxido reducción, por ello, es importante que conozcas a otro gran detective químico, que habla de este tipo de reacciones y su importancia en la vida diaria.
Es por eso que se te recomienda: “Más allá de la herrumbre I, II y III”
De los autores Javier Ávila Mendoza y Joan Genescá. Lo puedes encontrar en la colección “La Ciencia para Todos”.
O en la siguiente dirección electrónica:
http://bibliotecadigital.ilce.edu.mx/sites/ciencia/html/quimica.html
Reconoce que, a partir de un proyecto puedes entender, comprender y resolver fenómenos y procesos químicos que tienen impacto en la vida diaria.
Recuerda los 4 pasos de un Proyecto: Planeación, Desarrollo, Comunicación y Evaluación.
¡Buen trabajo!
Gracias por tu esfuerzo.
Descarga tu clase dando clic aquí



Login to join the discussion