¿Cómo explico la rapidez de las reacciones?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:11
Aprendizaje esperado : e xplica y predice el efecto de la temperatura y la concentración de los reactivos en la rapidez de las reacciones químicas, a partir del modelo corpuscular de la materia.
Énfasis: p r edecir el efecto de algunos factores en la rapidez de las reacciones químicas y explicar con base en el modelo corpuscular de la materia.
¿Qué vamos a aprender?
Lee la siguiente frase célebre del químico alemán e historiador científico Alwin Mittasch :
“Química sin catálisis, sería una espada sin un mango, una luz sin brillo, una campana sin sonido”.
El propósito de esta sesión es predecir el efecto de algunos factores en la rapidez de las reacciones químicas y la explicación con base en el modelo corpuscular de la materia.
¿Sabías que? Las varitas fluorescentes al ser dobladas o agitadas producen una luz fluorescente, sin la necesidad de combustión o pilas.
Esto sucede debido a que en las varitas hay dos compuestos químicos separados, que al juntarse reaccionan, uno es el peróxido de hidrógeno “denominado activador”, contenido en una pequeña y frágil cápsula de cristal, hecha de polietileno, y un éster de difenil oxalato, un tinte fluorescente, es el que le da color según el producto químico que contenga.
¿Qué hacemos?
De las numerosas reacciones químicas que ocurren a tu alrededor, no todas se realizan con la misma rapidez, por ejemplo, la maduración de un plátano y de una manzana.
Las hay muy rápidas, como las explosiones, y otras que transcurren mucho más lentamente, como la oxidación del hierro o la formación de las rocas que constituyen la corteza terrestre, procesos que pueden tardar incluso miles de años.
Por otra parte, convendría que algunas reacciones químicas ocurrieran más lentamente, por ejemplo, en las reacciones que originan la descomposición de los alimentos, mientras que sería interesante poder acelerar otras, como podría ser el caso de la acción de un medicamento.
El conocimiento de los factores que influyen en la velocidad de las reacciones químicas será imprescindible para poder actuar sobre ellos y acelerar o frenar estas reacciones.
Para que se produzca una reacción química entre dos sustancias debe haber colisiones, es decir choques, entre los átomos de esas dos sustancias, pero no sólo tienen que chocar entre sí, sino que también tienen que hacerlo con suficiente fuerza para que se produzca una reacción.
La cantidad de energía que deben tener los átomos cuando chocan se llama energía de activación de la reacción.
La energía de activación es distinta según el tipo de reacción.
Algunas reacciones tienen una energía de activación tan grande que no puede llevarse a cabo en condiciones normales.
Si alguna vez te has subido a los carritos chocones podrás entender que entre mayor sea la cantidad de carritos, mayor es la probabilidad de que haya una colisión entre ellos, es decir a mayor concentración, mayor probabilidad de choque, pero si quitas algunos de estos carritos, se reduce la probabilidad de que dos carritos se encuentren y choquen.
Lo mismo sucede con los átomos, entre más átomos hay, al reaccionar dos o más sustancias, existe mayor probabilidad de que choquen y produzcan nuevas sustancias.
Para entender de manera más clara esta analogía, analiza el siguiente video del inicio al minuto 6:28 :
-
Catalizadores e inhibidores
¿Cómo colisionan los átomos a diferente velocidad según los factores a los que se somete una reacción química?
Sólo los choques eficaces dan lugar a la formación de los productos de la reacción, por lo que aumentar o disminuir el número de choques eficaces que ocurren en la unidad de tiempo supondrá aumentar o disminuir la velocidad de reacción.
Para determinar con qué rapidez está sucediendo una reacción puedes medir la velocidad con la que desaparece uno de los reactivos o la velocidad con la que aparece uno de los productos.
Cualquiera de estas medidas te dará una cantidad de la sustancia que cambia por unidad de tiempo y eso es la velocidad de reacción.
¿Por qué es importante la velocidad de reacción?
Es importante, por ejemplo, para que un ingeniero químico diseñe un proceso para obtener un alto rendimiento de un producto.
Mientras mayor sea la velocidad, mayor cantidad de producto se formará por unidad de tiempo.
La velocidad de reacción también es importante en el procesamiento de alimentos, donde es indispensable retardar las reacciones que provocan su descomposición.
¿Puedes cambiar la velocidad de una reacción?
Lo aprenderás a nivel submicroscópico. Nivel submicroscópico, es la manera de entender lo que sucede con los átomos de las sustancias en una reacción. Para representar a los átomos utilizar as esferas.
Existen 4 factores principales que pueden afectar la velocidad de las reacciones:
1. La superficie de contacto de los reactivos: si los reactivos están en estado sólido, la pulverización aumenta la superficie de contacto, en consecuencia, aumenta la velocidad de reacción, ya que facilita la interacción entre los reactivos y, por tanto, la colisión entre los átomos.
Observa los modelos para representar cómo aumenta la superficie de contacto y por lo tanto la frecuencia de choques, de esta manera se lle va a cabo con mayor rapidez la reacción.
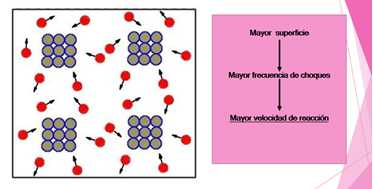
Cuando aumenta el contacto entre los reactivos, los átomos chocan con mayor frecuencia, lo que provoca que la reacción se lleve a cabo en menor tiempo.
Por ejemplo, si intentas prender madera, entre más pequeño sea su tamaño, más fácil arderá.
Esto se debe a que si los trozos son pequeños habrá más contacto entre la madera y el aire, por lo tanto, más átomos chocan unos con otros y es más rápida la reacción.
2. Al aumentar la concentración de los reactivos: Cambiar la cantidad de reactivos presentes también altera la velocidad de una reacción.
La concentración de una sustancia es la cantidad de sustancia presente en cierto volumen. Al aumentar la concentración de un reactivo, la reacción sucede más rápidamente porque hay más átomos por unidad de volumen.
Con más átomos, hay mayor número de colisiones, lo que produce una mayor velocidad de reacción.
Al disminuir la cantidad de reactivos se altera la velocidad, ya que, a menor concentración, menor frecuencia de choque y por lo tanto menor velocidad de reacción.
Como ejemplo, cuando el fuego se consume lentamente, al avivar las llamas con un abanico aumenta la cantidad de oxígeno disponible y el fuego arderá más rápido.
3. La temperatura: es uno de los factores que afectan la velocidad de una reacción.
La mayoría de las reacciones aumentan su velocidad a temperaturas elevadas.
La disminución de la temperatura hace que las reacciones se lleven a cabo en mayor tiempo.
A mayor temperatura hay mayor energía cinética entre los átomos, por lo tanto, la frecuencia de choques es mayor y la velocidad de reacción se incrementa.
Añadir calor a los reactivos, favorece la ruptura de enlaces y se incrementa la velocidad con la que se mueven los átomos y las moléculas. Mientras más rápido se muevan los átomos, mayor será la probabilidad de choque y de que reaccionen.
Al disminuir el calor, las reacciones se hacen más lentas, es por eso que tu vida cotidiana al congelar los alimentos sirve para retardar las reacciones de descomposición.
Como dato curioso: En tu cuerpo ocurren muchas reacciones químicas, sin ellas tu organismo no podría funcionar adecuadamente.
Por ejemplo, has escuchado que es muy importante el consumo de vitaminas al ingerir frutas y verduras; esto se debe a la acción que tienen de facilitar y acelerar reacciones químicas en tu organismo, con la finalidad de mantener tu sistema inmune, muy saludable, por ejemplo.
Las vitaminas también reciben el nombre de catalizadores biológicos.
Identifica el cuarto factor que acelera una reacción química, observa con atención el siguiente video del minuto 11:24 a 12:28 :
-
Catalizadores e inhibidores
S on muy importantes los catalizadores en la industria química, sin ellos no se podrían fabricar margarinas, plásticos, abonos, insecticidas y muchas de las sustancias q ue conoces y usas habitualmente.
Los catalizadores son sustancias que, aunque no parecen intervenir en la reacción porque se recuperan al terminar ésta, provocan que la reacción sea más rápida.
Su función hace posible que el paso de reactivos a productos se real ice por un “camino” diferente, más “fácil” energéticamente y, por tanto, con mayor rapidez.
Piensa en el tiempo que tardan en desplazarse entre dos localidades unidas por una carretera de montaña, qué sucede si la construcción de un túnel las comunicara, disminuiría el tempo de traslado. Llegamos al mismo lugar, en menos tiempo.
Lo mismo sucede en las reacciones, producen una variación de su velocidad sin tener ninguna alteración durante el transcurso de la reacción. Aunque los catalizadores participan de algún modo en las reacciones, finalmente quedan inalterados, por lo que no constan como reactivos ni como productos en la ecuación química.
Estos pueden ser positivos o negativos:
-
Positivos: son los que aumentan la velocidad de la reacción. Son los de mayor interés, ya que se utilizan en las industrias químicas.
-
Negativos: también conocidos como inhibidores, son los que disminuyen la velocidad de reacción. Resultan de especial interés en la industria alimentaria, en la que se usan como aditivos para retardar o impedir las reacciones que pueden alterar las propiedades de ciertos alimentos, como lo observaste en el video.
A partir de esta activ idad experimental, o bserva cómo se produce una reacción de descomposición del peróxido de hidrógeno, comúnmente llamado agua oxigenada.
Necesitarás:
-
Agua oxigenada
-
Trozos de hígado de pollo
-
1 matraz Erlenmeyer o 1 vaso de vidrio transparente
-
Cerillos
-
Colocas en el matraz o en el vaso pequeños trozos de hígado de pollo.
-
Agrega suficiente agua oxigenada.
-
Observa cómo se va produciendo la reacción química de descomposición del agua oxigenada, que se evidencia con la formación de espuma blanca. Los productos de esta reacción química son el oxígeno y el agua.
El hígado contiene la enzima catalasa, la cual es un poderoso antioxidante, es decir, que impide la oxidación de las sustancias químicas.
Si agregas agua oxigenada al hígado crudo, la catalasa aumenta la velocidad de la reacción de descomposición del peróxido de hidrógeno, por lo que se obtienen agua y moléculas de oxígeno que se liberan en forma de gas (O2), como evidencia observará s el burbujeo en tu experimento.
Al matraz se le puede acercar un cerillo encendido para comprobar que el gas obtenido es oxígeno, ya que el oxígeno es comburente y ayuda a avivar el fuego.
Cómo pudiste observar, los catalizadores son más comunes de lo que imaginas. Tu sangre también contiene esta enzima, la catalasa, por eso cuando curas una herida en tu cuerpo con agua oxigenada, es posible que observes la rapidez con la que se generan burbujas sobre la herida.
En la saliva también existe una enzima que interviene en las reacciones químicas que ocurren dentro de la célula, llamada amilasa, ésta se encarga de desdoblar o romper la molécula del almidón para producir moléculas más pequeñas, como la glucosa
Realiza otra actividad experimental.
Necesitas:
-
Peróxido de hidrógeno, conocido comúnmente como agua oxigenada.
-
Una pila, en específico utilizas el dióxido de manganeso.
-
Probeta.
¿Cómo lo haces?
-
Con mucho cuidado extrae de la pila el dióxido de manganeso.
-
Colocas en la probeta agua oxigenada.
-
Colocas el dióxido de manganeso con una cuchara.
Lo que observas es la acción de descomposición del agua oxigenada en agua, y oxígeno, el dióxido de manganeso funciona como un catalizador, acelerando la reacción. Al igual que en la primera actividad experimental, puedes colocar una llama de fuego y observar cómo se aviva debido a que el oxígeno es un comburente.
En la administración de medicamentos también ocurre aceleración de las reacciones químicas, las dos vías más habituales de administración son la intravenosa y la oral (inyecciones y pastillas).
Las inyecciones se utilizan cuando es necesario que el medicamento esté en sangre de forma inmediata, para que se absorba a las células y tenga actividad.
Sin embargo, las pastillas se utilizan en tratamientos prolongados.
Como aprendiste, las reacciones químicas están presentes en las acciones más cotidianas de la vida.
Investiga tres ejemplos de catalizadores biológicos, si te es posible da a conocer tus resultados a tu maestra o maestro.
Aprendiste que la rapidez de las reacciones químicas se puede modificar con factores como la temperatura, la concentración de reactivos y la intervención de catalizadores.
La nutrición y la química en tu vida cotidiana. Un conservador es una sustancia utilizada como aditivo alimentario, que añadida a los alimentos retarda el deterioro causado por la presencia de diferentes tipos de microorganismos (bacterias, levaduras y mohos).
Un ejemplo de conservadores muy común es el ácido sórbico E-200.
El ácido sórbico E-200 es el único ácido orgánico no saturado normalmente permitido como conservador en los alimentos. Posee un espectro antimicrobiano interesante, ya que es relativamente ineficaz contra las bacterias catalasa-negativas como las bacterias lácticas.
El r eto de h oy :
Para seguir aprendiendo sobre este tema te sugerimos leer la revista Conversus del Instituto Politécnico Nacional con la dirección electrónica.
¡Buen trabajo!
Gracias por tu esfuerzo.
Para saber más :
Lecturas


Login to join the discussion