¿Cómo medimos las propiedades intensivas de los materiales?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:11Aprendizaje esperado: Identifica las propiedades extensivas (masa y volumen) e intensivas (temperatura de fusión y de ebullición, viscosidad, densidad, solubilidad) de algunos materiales. Explica la importancia de los instrumentos de medición y observación como herramientas que amplían la capacidad de percepción de nuestros sentidos.
Énfasis: Medir algunas propiedades intensivas de los materiales.
¿Qué vamos a aprender?
Recuerda que una de las limitaciones al tratar de medir la materia mediante nuestros sentidos es que los datos obtenidos no son confiables ya que dependen de la capacidad de percepción de las personas.
¿Qué instrumentos se utiliza para medir las propiedades intensivas de la materia?
El propósito de esta sesión es medir las propiedades intensivas de algunas sustancias de uso cotidiano, a través de la experimentación.
Escribe en tu cuaderno el reporte de práctica de los experimentos que se desarrollaran a continuación tu reporte debe contener los siguientes datos, observa:

Finalmente reflexionarás sobre lo aprendido respondiendo las siguientes preguntas:

Las dudas, inquietudes o dificultades que surjan al resolver los planteamientos los puedes disipar consultando tu libro de texto de Ciencias. Química en el tema 2 del bloque 1.
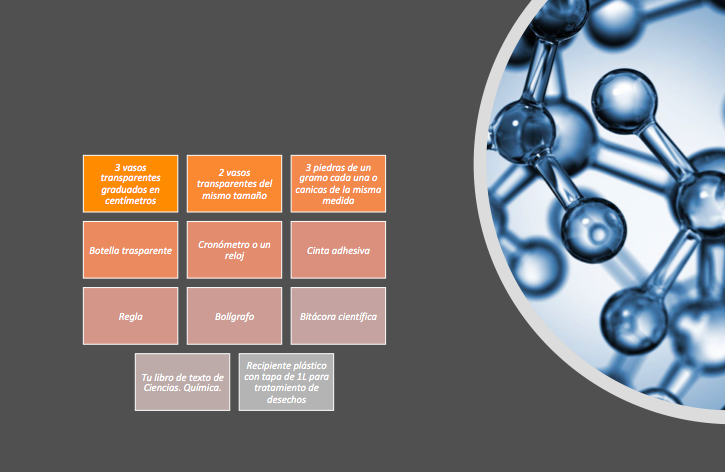
Los materiales que utilizarás en esta sesión y con los que cuentas en casa son los siguientes:
- 270 ml de aceite comestible de reúso
- 2 ml de miel
- 22 ml de detergente líquido
- 2 ml de alcohol
- 590 ml de agua
- 120 g de sal
- 3 vasos transparentes graduados en centímetros
- 2 vasos transparentes del mismo tamaño
- 3 piedras de un gramo cada una o canicas de la misma medida
- Botella trasparente
- Cronometro o un reloj
- Cinta adhesiva
- Regla
- Bolígrafo
- Bitácora científica
- Tu libro de texto de Ciencias. Química.
- Recipiente plástico con tapa de 1L para tratamiento de desechos.
Es importante que no repitas experimentos donde se utiliza fuego o termómetro, ya que los materiales que se usan en un laboratorio están especialmente diseñados para soportar altas temperaturas de ebullición y fusión, los vasos y termómetros clínicos que tenemos en casa no cumplen con esas características, si se utilizan por error pueden provocar accidentes.
Identifica siempre las sustancias con las que estás trabajando, etiquetándolas con su nombre.
Dispón de un recipiente de plástico con tapa y etiquétalo como “Aceite de desecho” y cuando este se haya llenado, entrega al responsable de la recolección de basura para continuar con el tratamiento adecuado de desechos.
Investiga acerca de su adecuado uso y manejo y si es necesario coloca un pictograma que te permita tomar las medidas de seguridad pertinentes.
Sabías que 1 mililitro (ml) de aceite de cocina que se arroja al agua, contamina 1000 Litros (L).
Conocerás cómo se pueden medir algunas propiedades intensivas de la materia y te darás cuenta de que están presentes en nuestra vida cotidiana.
Reflexiona sobre cómo aplicar este conocimiento a tu contexto inmediato.
¿Qué hacemos?
Analiza la siguiente presentación:
Para extraer la sal de la salinera s e canaliza el agua del océano en balsas planas de poca profundidad, esperan a que la luz solar evapore el agua, y el viento cristalice la sal de cloruro de sodio mezclada con otras sales.
La obtención del cloruro de sodio conocido como sal de mesa, implica separarlo de las otras sustancias, aprovechando las propiedades que la diferencian del resto.
¿Sabías qué? Por cada 1000 ml de agua hay 35 gramos de sales disueltas y que de estos 35 gramos el 80% corresponde al cloruro de sodio, también conocido como sal de mesa.

Según el proyecto de Norma Oficial Mexicana-SAGARPA 2018, la sal de mar debe cumplir con las siguientes características sensoriales: Ser una sustancia formada por cristales blancos, inodora de sabor salino franco, soluble en agua y con un grado de pureza de 99.90%, para el consumo humano.
Con el fin de comprender este fenómeno y proceso natural desde una perspectiva científica, realiza si es posible, el siguiente experimento parecido a lo que sucede en las salineras. Comienza por simular el agua del océano formando una disolución de 100 ml de agua mezclada con 5 gramos de sal.
Posteriormente vacía la disolución en un contenedor, sobre el cual pondrás un tapón de corcho e introducirás un termómetro para medir la temperatura exacta a la que comenzará a hervir el agua.
100 ml de agua, matraz, 5 gramos de sal, estufa, termómetro, tapón de corcho.
¿Por qué es importante medir las propiedades intensivas?
¿Qué propiedades se aprovechan en el funcionamiento de un instrumento adecuado para medir la temperatura de ebullición, la temperatura de fusión, viscosidad, densidad y solubilidad?
Las propiedades intensivas, como la dilatación y contracción térmica son dos propiedades que se han aprovechado para construir instrumentos de medición, llamados termómetros.
Los termómetros se clasifican de acuerdo con su uso:
- Clínicos: Tienen un rango de medición de temperatura de 35 a 40 grados Celsius.
- Ambientales: Consideran un rango de menos 30 a 50 grados Celsius.
- Laboratorio: Miden un rango de menos 20 a 400 grados Celsius, su funcionamiento se basa en la dilatación y la contracción térmica las cuales son directamente proporcionales, pues se encuentran calibrados al incremento o disminución de la temperatura.
En México los termómetros tienen una escala graduada en grados Celsius, en esta escala 0°C es la temperatura a la cual se congela el agua y 100°C es la temperatura a la cual hierve, cuando se encuentra a nivel del mar.
Los equipos que se utilizan a nivel industrial para medir el punto de fusión se basan en el cambio del estado sólido al estado líquido, registrando la temperatura a la que sucede dicho cambio.
Estos equipos utilizan un termómetro unido a la base de un platillo de metal, sobre la cual se coloca la muestra a analizar y sobre ésta un lente de aumento, que permite fácilmente observar el cambio de estado, y el registro de la temperatura.
Es momento de iniciar con los experimentos, recuerda hacer el registro de tu reporte de práctica.
Con este experimento demostrarás que la viscosidad es la resistencia de un líquido a fluir.
Necesitarás tres recipientes transparentes con tapa del mismo tamaño, graduados centímetro a centímetro desde la base hasta la superficie. Colocarás una piedra o una canica de la misma masa en cada uno de los contenedores. Etiqueta los recipientes con los nombres de las sustancias que van a contener, e introduce en cada uno la sustancia con la que fue etiquetado, hasta su total capacidad.
1. Aceite comestible de reúso.
2. Detergente líquido.
3. Agua.
4. Base para soportar los recipientes con tapa.
Coloca una cinta adhesiva por encima de los recipientes con tapa y antes de voltear tus recipientes. Reflexiona:
¿En qué recipiente crees que llegará la piedra al fondo más rápidamente?

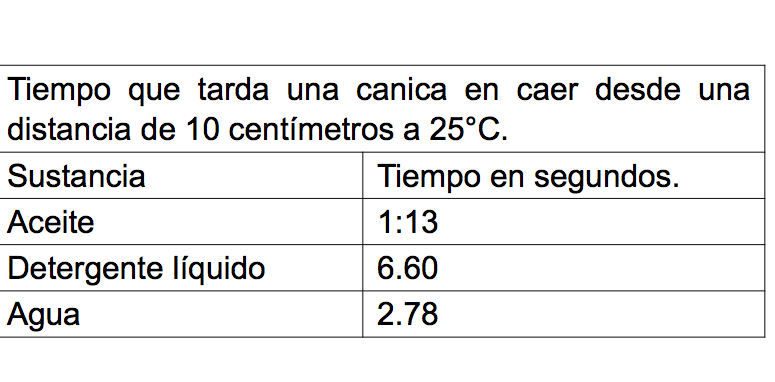
Registra tus resultados en una tabla como la que se muestra a continuación.


En este caso el detergente es la sustancia más viscosa porque la canica tardó más tiempo en llegar al fondo del recipiente.
¿Tus resultados confirman o rechazan la hipótesis?
A nivel industrial para obtener medidas exactas de viscosidad se utiliza un viscosímetro en el que se manejan unidades de medida como el metro cuadrado por segundo (m2 /s) y pascal por segundo (Pa·s).
Ambas consideradas dentro del Sistema Internacional de unidades (SI). Aunque medir es un acto que realizas con frecuencia en la vida cotidiana, pocas veces reconoces su importancia durante la experimentación, por lo que cabe destacar que, en el campo de la ciencia, es gracias a ésta, que has podido conocer y describir las propiedades de la materia con base en sus diferencias.
Expresar y graficar los resultados experimentales durante el trabajo científico implica aislar, reproducir el fenómeno de estudio bajo condiciones controladas y es este proceso el que permite recabar datos valiosos para ser analizados, interpretados y poner a prueba las hipótesis planteadas.
Cabe destacar que, en el mundo de la ciencia, no está permitido plantear una hipótesis sin antes haber realizado una investigación bibliográfica sobre el fenómeno a investigar.
No obstante, te sugerimos que te atrevas a plantear predicciones de lo que va a suceder durante cada experimento y que registres tus hipótesis, a fin de que si te equivocas te motives a investigar el porqué.
Recuerda que el conocimiento científico tiene un carácter tentativo, es decir, que nada es definitivo, pues este avanza al mismo ritmo que progresa la tecnología y la sociedad. Y recuerda, si quieres aprender en la ciencia química tienes que experimentar.
Sabías que un litro de aceite no tiene la misma masa que un litro de agua. Esto se debe a la propiedad intensiva conocida como densidad, la cual se define como la relación entre la cantidad de masa en una sustancia por unidad del volumen que ocupa.
Antes de medir la densidad de un líquido es importante calibrar el densímetro colocándolo dentro de una sustancia con un valor bien conocido por el experimentador, la cual se compara con una tabla de valores también conocidos y tomados bajo las mismas condiciones de presión y temperatura de la muestra sobre la que medirás la densidad.
La densidad de una sustancia se mide utilizando una probeta que se llena hasta la marca máxima de su graduación en este caso 250 ml de agua en la primera probeta y 250ml de aceite en la segunda probeta.

Recuerda que para medir adecuadamente el volumen de un líquido utilizando instrumentos volumétricos como lo es la probeta, es importante tomar en cuenta la formación del menisco, el cual puede ser una superficie cóncava o convexa, según si las moléculas del líquido se atraen o se repelen con el vidrio.

La concavidad del menisco se origina cuando las fuerzas de adhesión entre un líquido y las paredes del recipiente que las contiene son mayores que las de fuerzas de adhesión del líquido.
La convexidad del menisco se da cuando las fuerzas de cohesión del líquido son mayores que las de adhesión.
La superficie de los líquidos presenta una propiedad intensiva conocida como tensión superficial. La cual actúa succionando el líquido cuando el menisco es cóncavo y rechazándolo cuando es convexo, cualquier material que ingrese al líquido debe vencer esa fuerza o tensión.
Para realizar la lectura del líquido en la probeta esta debe estar colocada en una superficie plana y al medirla debe coincidir la curva que se forma en el líquido en la parte central con el aforo o graduación de la probeta.
Una vez que tienes la medida correcta del volumen medirás la densidad, para lo cual se introduce el densímetro verticalmente con cuidado dentro del líquido y espera hasta que flote libre y verticalmente.
Posteriormente se observa en la escala graduada su nivel de hundimiento en el líquido; esa es la lectura de la medida de densidad relativa del líquido. La densidad de ambas sustancias se muestra así:
Para el aceite 0.84g/cm3 y para el agua 1g/cm3.
Al comparar el valor de densidad de ambas sustancias puedes comprender que por sus diferencias de densidad estos dos líquidos son inmiscibles entre sí y puedes decir que la posición que adoptan cuando ambos se juntan, se le conoce como densidad relativa.
Observa el siguiente ejemplo:
Necesitarás una botella transparente con una cinta adhesiva dividida en tres partes iguales, pegada en la parte de atrás.
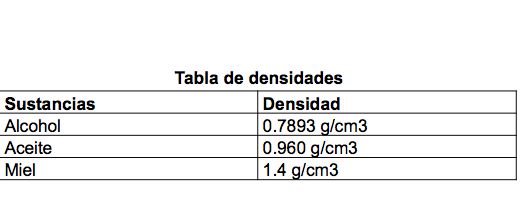
Utilizarás las siguientes sustancias: alcohol, miel y aceite.
¿Te atreverías a predecir de manera ascendente la densidad de las sustancias?
Te sugerimos utilizar la siguiente tabla.
Registra tu hipótesis en el reporte de práctica. Colocarás las sustancias en la botella, vertiéndolas en el orden de mayor a menor densidad.
La densidad de una sustancia varia con la temperatura y también si se disuelve en ella otra sustancia, de ahí que el orden en el que las viertas en la botella es importante para mantenerlas separadas.
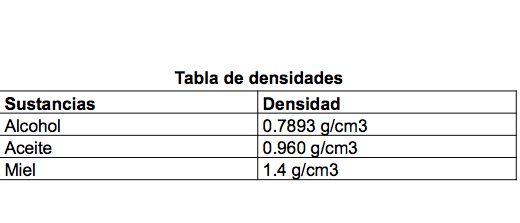
Es sorprendente como estas sustancias no se mezclan, la densidad sin duda es una propiedad que se puede aprovechar para separar las sustancias de una mezcla. ¿Sabes qué tipo de mezcla es la torre de fluidos?
Para medir la solubilidad de las sustancias se utilizan curvas de solubilidad, las cuales son representaciones de la solubilidad de una sustancia en función de la temperatura.
Observa que de acuerdo con el plano cartesiano en el eje de las “X se encuentra la temperatura y en el eje de las “Y” se encuentra el coeficiente de solubilidad expresado en g de soluto disueltos en 100g de agua.
Resuelve las siguientes actividades en tu libreta utilizando la gráfica de solubilidad de algunas sales en agua, en función de la temperatura.
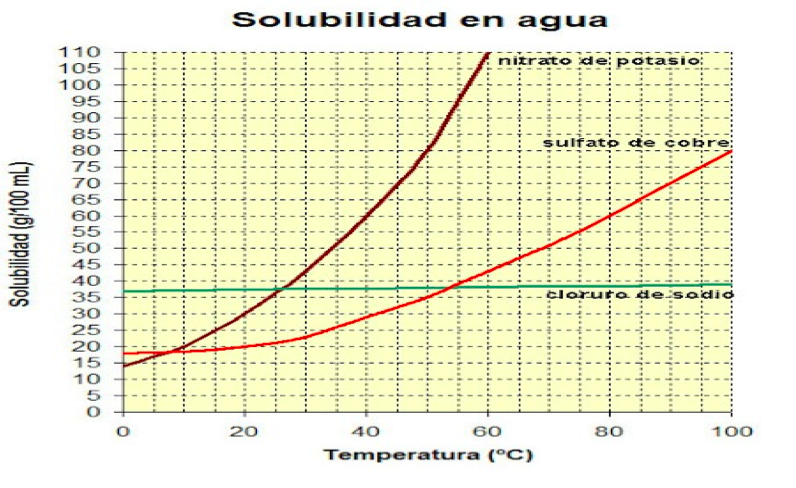
Puedes observar que en ella se presentan tres curvas de sustancias distintas cada una. Identifica la curva que corresponde al soluto con el que vas a trabajar y guíate sobre esa curva para analizar los datos y encontrar la respuesta correcta.
El soluto es cloruro de sodio cuya fórmula química se escribe NaCl.
¿Qué cantidad de cloruro de sodio (NACl) se disuelve a 50°C?
Para resolver el primer planteamiento considera que el dato que proporcionan corresponde al eje de las “X” por lo que te ubicarás en este eje hasta encontrar 50°C y subirás verticalmente hasta topar con la curva y lee en el eje de las “Y” que la concentración del cloruro de sodio a 50°C es de 39 gramos de soluto disueltos en 100g de agua.
2. ¿A qué temperatura se disuelve el cloruro de sodio si se disuelven 40g de cloruro de sodio en 100g de agua?
Para resolver el segundo planteamiento considera que el dato que se proporciona ahora corresponde a la concentración de la solución que es de 40g de soluto disuelto en 100 g de disolvente, por lo que se ubica en el eje de las “Y” hasta encontrar los 40 gramos y posteriormente caminas en el eje de las “X” hasta topar con la curva y bajar en el eje de las “Y” para encontrar la temperatura, la cual corresponde a 90°C.
Establece que la solución que preparas tendrá una temperatura de 90°C y que la cantidad del disolvente o agua será de 100g, como te has dado cuenta ya solo modificarás la cantidad del soluto cloruro de sodio, en el primer caso utilizarás 20 g de sal, en el segundo 40 g y en el tercer caso 60 g.
Ahora ubícate entonces en el eje de las “X” dado que la temperatura y la cantidad de disolvente no cambian y subes verticalmente sobre el eje de la “Y” para encontrar y marcar cuando llegues a 20g de soluto y colocas una marca, posteriormente cuando llegues a 40g de soluto y luego a 60g.
Una vez que has marcado te das cuenta de que la marca que se encuentra sobre la curva corresponde a la solución saturada, la marca que se encuentra por debajo de la curva es la correspondiente a la solución diluida y la que se encuentra por encima de la curva es la solución sobresaturada.
Caracterizar e identificar las sustancias, es una actividad que se utiliza para la construcción del conocimiento científico el cual se basa en un conjunto de procedimientos en los que utilizas tus sentidos para experimentar con algunos hechos que han despertado nuestro interés.
La experimentación que llevas a cabo partió del hecho de demostrar cómo es que los instrumentos de medición amplían la capacidad de percepción de nuestros sentidos y es que a partir de estos has podido identificar y medir las propiedades intensivas, temperatura de fusión y de ebullición, viscosidad, densidad, solubilidad, todas ellas independientes de la cantidad de materia.
El Reto de Hoy:
Ahora que has aprendido a medir las propiedades intensivas de la materia puedes concluir que efectivamente estas no dependen de la cantidad de materia y que su medición ayuda a identificarlas, pues un material puede tener cualquier magnitud de masa y volumen, pero sólo una y específica magnitud de densidad, viscosidad, solubilidad, temperatura de ebullición y de fusión.
Los instrumentos de medición son herramientas útiles y efectivas para poder cuantificar las propiedades de los materiales, recordemos que para cada propiedad se emplea un instrumento de medición específico, con excepción de las temperaturas de fusión y ebullición, estas se miden con el termómetro de laboratorio.
Entre otras propiedades observaste que la viscosidad de un líquido es su resistencia para fluir y en el Sistema Internacional de Unidades se expresa en pascal por segundo, se mide con el instrumento llamado viscosímetro.
Recuerda es conveniente sistematizar los resultados obtenidos al experimentar, así como seguir las normas de seguridad para evitar accidentes.
Descarga tu clase dando clic
¡Buen trabajo!
Gracias por tu esfuerzo.


Login to join the discussion