¿Cómo se representa el conocimiento químico?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:11Aprendizaje esperado: Representa mediante la simbología química, elementos, moléculas, átomos, iones (aniones y cationes).
Énfasis: Representar con estructura de Lewis y con otra simbología química, elementos, moléculas, átomos, iones (aniones y cationes).
¿Qué vamos a aprender?
En esta sesión se representará con la estructura de Lewis y con otra simbología química, elementos, moléculas, iones (aniones y cationes).
El uso de símbolos permite una comunicación clara, precisa y universal.
A lo largo de la sesión te apoyarás de la tabla periódica para identifiicar las propiedades de los elementos químicos.
Es importante interpretar la información que contiene la tabla periódica, ésta es un sistema de clasificación, si la revisas, entenderás que todas esas letras, no es otra cosa que los símbolos de los elementos que la conforman, poco a poco, entenderás porque hay una ubicación específica para cada elemento químico.
Con base en su ordenamiento periódico los elementos químicos tienen determinadas propiedades que son aprovechadas para su obtención, así como en diferentes aplicaciones tecnológicas.
Lo maravilloso del estudio de los elementos químicos es que permite entender y predecir su comportamiento y sus interacciones entre átomos iguales y diferentes.
Lee la siguiente frase célebre de Peter Atkins: “La química comienza en las estrellas. Las estrellas son la fuente de los elementos químicos, que son los componentes básicos de la materia”.
Un dato interesante es que los elementos químicos se representan con símbolos integrados por una o dos letras de su nombre en latín, griego o árabe en la mayoría de los casos.
Los materiales que utilizarás son los siguientes: cuaderno, bolígrafos, lápiz, colores y Tabla periódica.
Registra todas las dudas e inquietudes que surjan durante la sesión, así como las actividades propuestas.
Si ya cuentas con tu libro de texto, puedes consultarlo, para retroalimentar y reflexionar sobre el uso de la regla del octeto de Lewis.
¿Qué hacemos?
En algún artículo o reportaje de televisión podrás percatarte que ocupan la misma simbología de la tabla periódica, así como las letras de los elementos químicos que la conforman.
En la química, durante su desarrollo se ha construido un lenguaje, que es interpretado por los estudiantes y profesionales de esta ciencia, igual como lo estás haciendo, necesitas aprender el lenguaje químico, de manera dinámica, para que tu conocimiento siga en constante construcción y que mejor si al mismo tiempo te diviertes.
Reflexiona:
- ¿El lenguaje de la química es universal? ¿porqué?
- ¿Cuáles son los electrones de Valencia?
- ¿Qué es la estructura de Lewis o diagrama de puntos?
Ten a la mano tu tabla periódica. Aprenderás algo interesante y didáctico con ella, puedes darte cuenta de que se conforma de 18 familias y 7 periodos, entonces para este tema, dobla la tabla para que queden ocultas las familias de la 3 a la 12, al ocultar dichas familias observa las que quedaron y después te enterarás porque realizaste esto.
¿El lenguaje de la química es universal?, ¿por qué?
Los conocimientos químicos se pueden interpretar en cualquier parte del mundo, ya que la simbología y el lenguaje es universal, para eso inicia por saber quién fue Gilbert Newton Lewis.
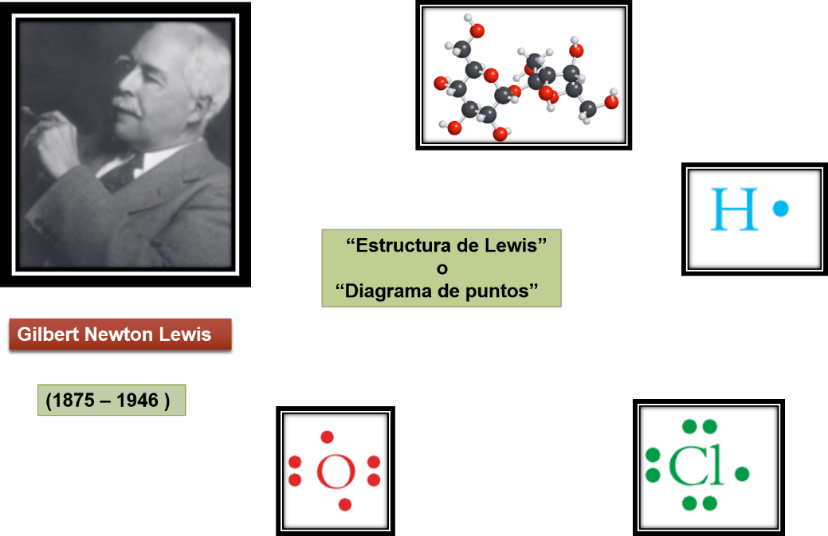
Mejor conocido como Lewis, fue un científico estadounidense quien destaco en química, famoso por su trabajo sobre la denominada “Estructura de Lewis” o “Diagrama de puntos”.
¿Sabías que? Un dato interesante, es que Gilbert Newton Lewis, nace 4 años antes que Albert Einstein. Einstein, por un lado, se inspiró en Isaac Newton para sus estudios y por otro lado llegó a tener cierta rivalidad con Newton Lewis. Sí que tenía sus Newton opuestos.
¿Cuáles son los electrones de valencia?
Como recuerdas en el modelo de Bohr, cuando realizas el acomodo de electrones se empieza con las órbitas más cercanas al núcleo, los cuales reciben el nombre de electrones internos.
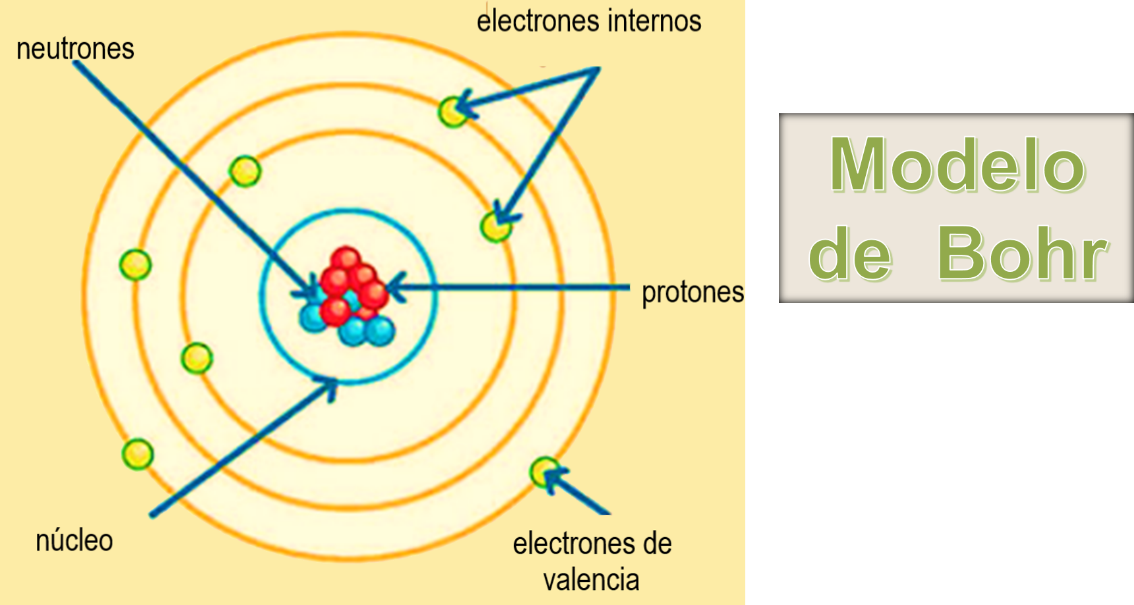
La órbita más alejada del núcleo es la de mayor energía, recibe el nombre de capa de valencia y los electrones que se encuentran, reciben el nombre de electrones de valencia, la mayoría de los átomos de los elementos no tiene completa su capa de valencia, en consecuencia, son inestables.
Pero, si son inestables ¿por qué se unen los átomos entre sí?
Para completar su capa de valencia, los átomos de los elementos se unen entre sí. Al hacerlo puedes perder, ganar o compartir uno o más electrones de valencia.
¿Cuál es la función de los electrones valencia? La función de los electrones de valencia es que participan en la unión entre átomos.
¿Qué es la estructura de Lewis o diagrama de puntos? Es la representación de los electrones de valencia de los átomos de elementos químicos por medio de puntos. También se representan las uniones o enlaces entre átomos iguales o diferentes.
¿Es fácil utilizar la estructura de Lewis o diagrama de puntos? Sí, lo primero que debes hacer es escribir el símbolo de un elemento y a su alrededor se dibujan puntos que representan los electrones de valencia.
Para colocar los electrones de valencia se colocan como si fueran los puntos cardinales en dirección de las manecillas del reloj de tal forma que se empieza por arriba, derecha, abajo e izquierda, si faltaran más electrones por colocar se hace lo mismo de tal forma que queden por pares en cada cuadrante.
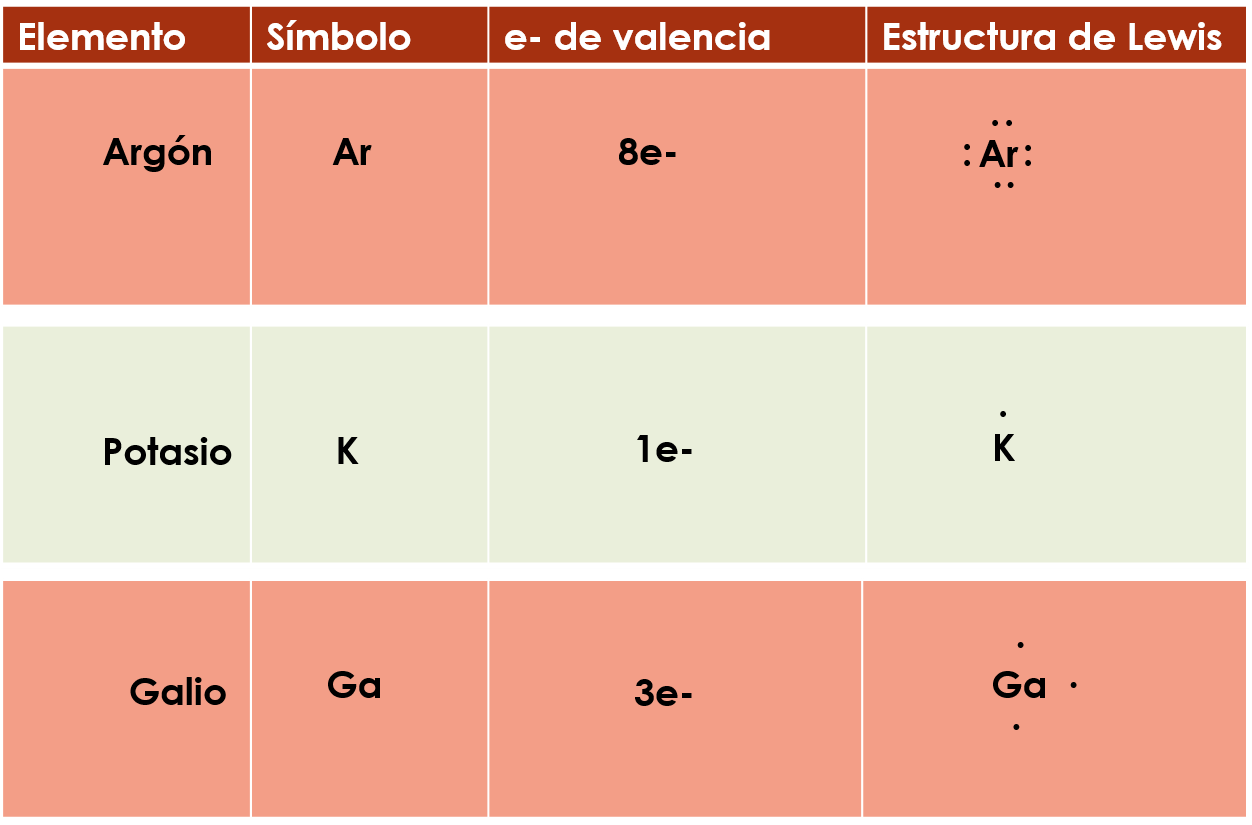
Ejemplo, el argón, su símbolo es Ar, tiene 8e- de valencia porque se encuentra en la familia 18, coloca su símbolo y empieza a colocar sus electrones por medio de puntos alrededor de él, uno, dos, tres, cuatro, tienes ya un electrón de valencia en cada cuadrante así que sigue el mismo orden y coloca los que faltan, cinco, seis, siete y ocho, observa cómo queda su estructura de Lewis o diagrama de puntos, ésta sí que quedo completa.
Entonces con este ejemplo observa como los átomos de los elementos del grupo 18 o gases nobles tienen completo su último nivel de energía, con ocho electrones de valencia.
Realiza otro ejemplo, tienes al potasio, su símbolo es K, sus átomos tienen 1 electrón de valencia porque pertenece al grupo 1, coloca su símbolo y su electrón de valencia, observa cómo queda su estructura de Lewis o diagrama de puntos.
Tienes al Galio, su símbolo es Ga, sus átomos tienen tres electrones de valencia porque pertenecen al grupo 13, ahora coloca su símbolo y empieza a colocar los electrones de valencia en sentido de las manecillas del reloj, observa cómo queda su estructura de Lewis o diagrama de puntos.
Realiza una actividad con lo que se acaba de explicar, pero con los siguientes elementos: azufre, calcio, fósforo, carbono y cloro. En ella debes colocar su símbolo, sus electrones de valencia y con esos datos será fácil realizar la estructura de Lewis.

La tabla periódica les será de gran utilidad para esta actividad y facilitará identificar el símbolo, así como sus electrones de valencia.
¿Por qué los átomos de diferentes elementos tienden a adquirir el mismo número de electrones que los átomos de los elementos del grupo 18?
Es interesante como los átomos de los elementos al ganar, ceder o compartir electrones completan su estructura de ocho electrones de valencia, y cada elemento al realizarlo, dicho de otra manera, tienden a adquirir la estructura de los átomos de los elementos del grupo 18 porque son más estables.
A los elementos del grupo 18 se les llama también gases nobles, inertes o raros. En este grupo se encuentran los elementos: helio, neón, argón, criptón, xenón, radón.
¿Por qué realizaron ese doblez en su tabla periódica al inicio de esta sesión?
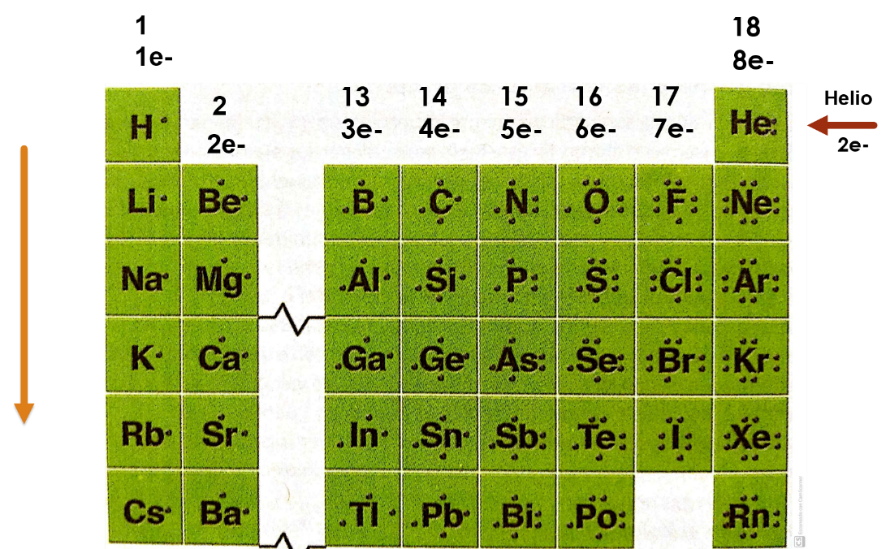
Esto te facilita la observación y el análisis de los grupos de los elementos representativos, así el grupo 1 donde se encuentra el hidrogeno, los átomos de los elementos que pertenecen a este grupo tienen un electrón de valencia.
El grupo 2, que pertenece el elemento berilio, los átomos de los elementos de este grupo tienen 2 electrones de valencia.
El grupo 13 donde se encuentra el boro, todos los átomos de los elementos de este grupo tienen tres electrones de valencia.
El grupo 14, donde se encuentra el carbono, los átomos de los elementos que pertenecen a este grupo tienen cuatro electrones de valencia.
El grupo 15, donde se encuentra el nitrógeno, los átomos de los elementos de este grupo tienen cinco electrones de valencia.
El grupo 16, donde está el oxígeno, los átomos de los elementos que pertenecen a este grupo tienen seis electrones de valencia.
El grupo 17, en donde se encuentra el flúor, los átomos de los elementos de este grupo tienen siete electrones de valencia.
Por último, el grupo 18 donde está el helio los átomos de los elementos que pertenecen a este grupo tienen ocho electrones de valencia, a excepción del helio que tiene dos electrones de valencia porque solo tiene una órbita y está completa, porque es el máximo número de electrones que puede contener dicha órbita.
Es momento de hacer un espacio de humor químico, de lo que has aprendido y ocupo al Helio.
Resulta que:
Golpearon a Helio, ¿por qué?, porque es muy noble, ¿Y qué hizo?, no reaccionó.
¿Ceder, ganar o compartir electrones? Cabe señalar que los átomos de los elementos son eléctricamente neutros, es decir, tienen el mismo número de protones que de electrones.
Los iones son átomos de elementos químicos cargados eléctricamente, si los átomos de un elemento tienen mayor número de protones que de electrones su la carga es positiva y son nombrados como cationes.
Mientras que, si los átomos de los elementos químicos tienen mayor número de electrones que de protones, su carga es negativa y son llamados aniones.
Observa el siguiente video para comprender más acerca de la estructura de Lewis.
- Átomos estables
Los electrones de valencia de los átomos de los elementos químicos son las partículas que intervienen cuando los átomos se unen.
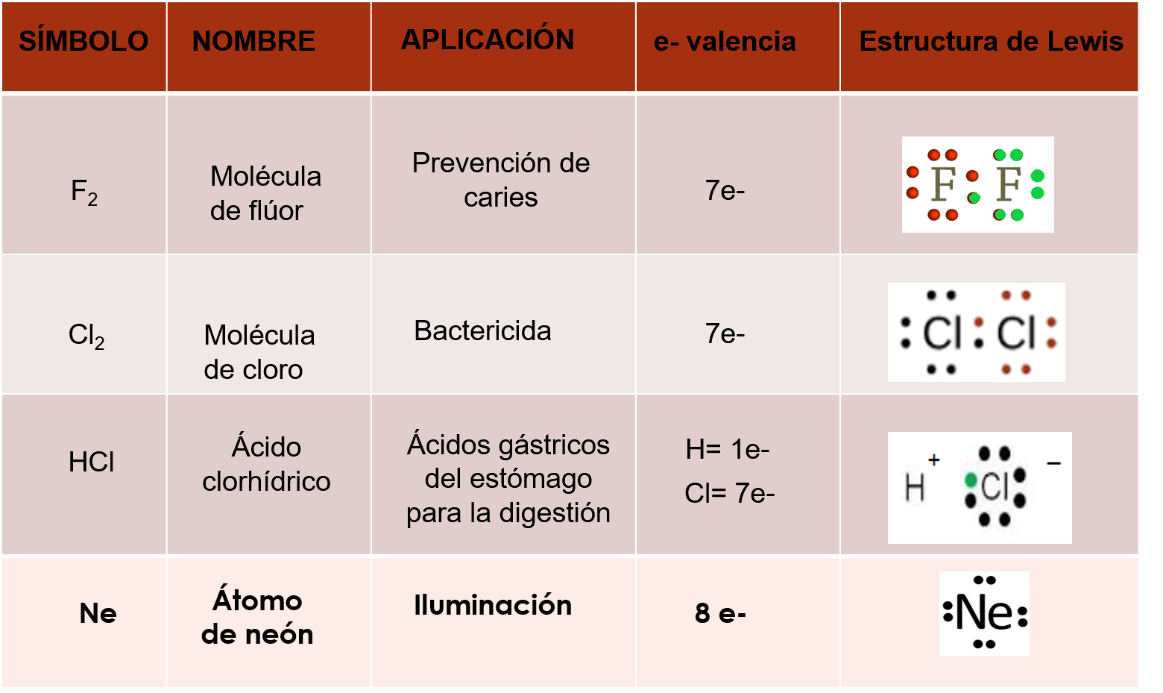
El elemento flúor, uno de sus usos es la prevención de caries, sus átomos tienen siete electrones de valencia, cuando se unen dos átomos de este elemento, ambos comparten un electrón de valencia, en consecuencia, completan los ocho electrones de valencia en su último nivel de energía. Observa la representación en la estructura de Lewis de la molécula de flúor.
Una de las aplicaciones del hipoclorito cloro, es bactericida. Los átomos de cloro tienen 7 electrones de valencia, cuando se unen entre sí, cada átomo comparte un electrón de valencia, por lo que ambos completan los ocho electrones de valencia, en su último nivel de energía. Observa la representación de la molécula de cloro en la estructura de Lewis.
Una de las aplicaciones del ácido clorhídrico, es la digestión, pues forma parte de los jugos gástricos. El hidrógeno tiene un electrón de valencia, mientras que el cloro tiene 7 electrones de valencia. El hidrógeno pierde su único electrón y el cloro con sus siete electrones de valencia atrae el electrón del hidrógeno y se completan los ocho electrones de valencia del cloro. En consecuencia, hay formación de iones, el hidrógeno queda con carga positiva y el cloro con carga negativa, observa cómo se representa con la estructura de Lewis.
El Reto de Hoy:
Con base en el video y con ayuda de la tabla periódica realiza la siguiente actividad.
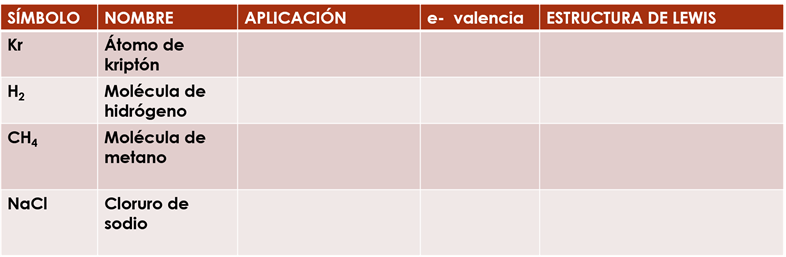
La representación de la estructura de Lewis tiene las siguientes funciones:
- Identificar los electrones de valencia de los átomos de los elementos químicos.
- Reconocer cómo interactúan los átomos del mismo elemento químico o de elementos diferentes.
- Visualizar la formación de moléculas (átomos iguales o diferentes) o de iones (átomos diferentes).
- Predecir la estabilidad de los átomos de un elemento o de un compuesto químico.
Recuerda que en tu libro de texto también puedes consultar el tema para aclarar cualquier duda.
Lee de la biblioteca digital del ILCE el libro El carbono: cuentos orientales.
Autores: Pedro Bosch y Graciela Pacheco
http://bibliotecadigital.ilce.edu.mx/sites/ciencia/volumen3/ciencia3/139/htm/carbono.htm
Descarga tu clase dando clic
¡Buen trabajo!
Gracias por tu esfuerzo.


Login to join the discussion