¿Cuál es la energía que se desprende o se absorbe en una reacción química?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:12
¿Cuál es la energía que se desprende o se absorbe en una reacción química?
Aprendizaje esperado: identifica que en una reacción química se absorbe o se desprende energía en forma de calor.
Énfasis: explicar que en una reacción química se absorbe (reacción endotérmica) o se desprende (reacción exotérmica) energía en forma de calor a partir de actividades experimentales.
¿Qué vamos a aprender?
Aprenderás que en una reacción química se absorbe o se desprende energía en forma de calor a partir de actividades experimentales. A estas reacciones se les llama reacciones endotérmicas y reacciones exotérmicas respectivamente.
Lee la siguiente frase: “Lo que sabemos es una gota de agua; lo que ignoramos es el océano”. Isaac Newton.
Los materiales que necesitarás son tu cuaderno, tu libro de texto, lápices, bolígrafos, colores y tu quimi-glosario.
¿Qué hacemos?
¿Qué diferencias existen entre un cambio químico y un cambio físico? ¿Las reconoces?
Elabora una tabla con ejemplos de 5 cambios físicos y 5 cambios químicos en tu cuaderno.
Cambio o reacciones químicas son transformaciones en las sustancias que las convierte en otras diferentes.
Son cambios que experimenta una sustancia y que involucran ruptura y formación de enlaces químicos para generar una sustancia nueva.
Todas las reacciones químicas obedecen a dos leyes fundamentales:
La ley de la conservación de la masa. En toda reacción química la masa se conserva, es decir, la masa total de los reactivos es igual a la masa total de los productos.
Y la ley de la conservación de la energía. La energía no puede crearse, ni destruirse en una reacción química o proceso físico; se conserva, se transforma, se transfiere o se disipa.
La energía es un concepto abstracto, aunque es un término utilizado en el lenguaje cotidiano, por ejemplo, cuando se dice “estoy muy cansado, me falta energía”.
A diferencia de la materia, la energía se reconoce por sus efectos; no puede verse, tocarse o pesarse.
Para describir los cambios de energía que ocurren durante un proceso, se necesita de la termoquímica, que estudia los cambios de calor en los procesos químicos.
Pero se tiene que hablar de lo que es un sistema, que no es otra cosa que la parte específica que te interesa.
Debido a que la energía no se crea ni se destruye, cualquier pérdida de energía en el sistema implica que ésta se transfiere a los alrededores.
La energía se transfiere o se disipa, y se puede transformar en calor o en trabajo.
Todas las formas de energía se pueden convertir unas en otras.
Por ejemplo, un automóvil funciona gracias a los cambios químicos; el motor del vehículo trabaja bajo la combustión de la gasolina, ésta, al romper sus enlaces, se convierte en energía cinética que propicia el movimiento, mientras otra parte se disipa en forma de calor. Sin embargo, la cantidad de energía se mantiene.
Otro ejemplo de cómo la energía se transforma es cuando estas bajo la luz solar, esto aumenta la temperatura corporal debido a la acción de la energía radiante que se convierte en energía térmica.
Cuando haces ejercicio, parte de la energía química almacenada en el cuerpo se utiliza para producir energía cinética.
Cualquier tipo de energía se conserva porque se transforma, se transfiere y se disipa.
Siempre que la energía se transforma o se transfiere existe un proceso de disipación, generalmente en forma de calor.
Este principio se resume en la ley de la conservación de la energía. Debido a ello, la energía total del universo permanece constante.
Se habla de flujo de calor desde el objeto de mayor temperatura hacia uno de menor temperatura.
El término calor significa transferencia de energía. Otros dos mecanismos de transferencia de energía además del calor, son el trabajo y la luz.
Analiza, si se tiene un recipiente de metal, y se seleccionó de metal porque es un excelente conductor de calor, el cual contiene agua a temperatura de ebullición. Ahora sumerjámosla en un recipiente con agua, después de un lapso observas la temperatura de ambos recipientes con agua.
¿Qué piensas que ocurrirá?
La temperatura de ésta se ha incrementado, mientras que la del recipiente de metal ha disminuido.
Por lo tanto, el calor es la transferencia de energía entre dos cuerpos o sistemas que están a diferentes temperaturas. En consecuencia, transcurrido el tiempo, ambos alcanzan la misma temperatura llegando a un equilibrio térmico.
En este contexto todas las reacciones químicas absorben o liberan energía, por lo general en forma de calor.
Cuando el calor es absorbido se dice que la reacción es endotérmica; cuando el calor es liberado se dice que la reacción es exotérmica.
Una reacción endotérmica es aquella que cuando ocurre, absorbe energía en forma de luz o calor. Cuando este tipo de reacción ocurre los productos obtenidos tienen mayor energía que los reactivos iniciales. La variación de entalpía para este tipo de reacciones es mayor que cero (ΔH>0).
Algunos ejemplos de reacciones endotérmicas son:
La formación de ozono en la atmósfera. Esta reacción es impulsada por la radiación ultravioleta del Sol, las moléculas de oxígeno O2 se transforman en O3, absorbiendo energía de dicha reacción en el proceso.
3O2(g) + energía (luz ultravioleta)
→ 2O3(g)
La electrólisis del agua. Al separar el hidrógeno y el oxígeno que componen el agua H2O, es necesario añadir energía eléctrica en un procedimiento llamado electrólisis. En el proceso, ambos tipos de átomos responden a los polos generados por la corriente eléctrica añadida, se rompe su enlace químico y se consume energía.
2H2O(l) + energía → 2H2(g) + O2(g)
La fotosíntesis. Nuestro planeta recibe la energía proveniente de las reacciones del Sol.
Las plantas transforman esta energía luminosa en energía química, en un proceso que se conoce como la fotosíntesis.
El proceso de nutrición de las plantas se da por medio de una serie de reacciones químicas que descomponen el dióxido de carbono (CO2) ambiental en presencia de agua y luz solar. Esta serie de reacciones necesita consumir energía para ocurrir.
6H2O(l) + 6CO2(g) +energía → C6H12O6(s) + 6O2(g)
Una reacción exotérmica es aquella que cuando ocurre libera energía en forma de calor al ambiente. Cuando sucede este tipo de reacción, los productos obtenidos tienen menor energía que los reactivos iniciales. La variación de entalpía para este tipo de reacciones es menor que cero (ΔH<0).
Todas las formas de combustión y de oxidación son ejemplo de este tipo de reacciones, como es el caso de la gasolina o los combustibles fósiles, que al ser quemados en presencia de oxígeno liberan una cantidad de energía muy superior a la introducida inicialmente que es el chispazo del motor.
Otro ejemplo de reacciones exotérmicas es la respiración celular; cuando se ingieren plantas, se suministra de la energía acumulada por medio de la molécula de la glucosa, y con el oxígeno, el cual llega a nuestras células llevándose a cabo diferentes procesos químicos como la glucólisis y ciclo de Krebs, los cuales contribuyen para que esa energía sea transferida a otra molécula llamada Adenosín Trifosfato (ATP), que es aprovechada por las células.
Retoma lo que es un sistema para poder comprender a las reacciones químicas en términos de intercambio de energía.
Tienes un sistema en este experimento de neutralización de ácido-base. El cual se hará de forma demostrativa, y no debes intentarlo en casa.
Observa este sistema. Está comprendido por este recipiente que contiene 50 ml de ácido clorhídrico, al cual se le agrega 50 ml de hidróxido de sodio. El sistema es el interior del recipiente, que contiene a los reactivos y donde se lleva a cabo la reacción.
Existen sistemas abiertos, que permiten el intercambio de masa y energía, que generalmente es el calor.
Como en este caso este sistema está formado por una cantidad de agua y está abierto. Si se cierra el recipiente, de tal manera que el vapor de agua no se escape o condense, se crea un sistema cerrado, el cual permite la transferencia de energía en forma de calor, pero no de masa.
Otro ejemplo de sistema es la combustión de hidrógeno gaseoso con oxígeno es una de muchas reacciones químicas que liberan una gran cantidad de energía.
En el desastre del Hindenburg, un zeppelin que era una aeronave llena de hidrógeno gaseoso.
2H2(g) + O2(g) → 2H2O(l) +energía.
En este caso las moléculas de hidrógeno, oxígeno y agua son el sistema, y existe una transferencia de energía, en este caso de calor.
Considera ahora otra reacción; la descomposición de óxido de mercurio (II) a altas temperaturas.
Energía + 2HgO(s) → 2Hg(l) + O2(g)
Esta reacción es un ejemplo de proceso endotérmico, en el cual los alrededores deben suministrar energía en forma de calor al sistema.
En las reacciones endotérmicas la diferencia entre la energía de los productos y la energía de los reactivos es igual al calor suministrado por los alrededores al sistema.
Ahora continua con otro ejemplo de una reacción química sencilla. Advertencia, se hará de forma demostrativa, con las medidas de seguridad pertinentes para evitar accidentes. No la realices en casa.
Se tiene peróxido de hidrógeno, su fórmula es H2O2, se vierte en un vaso de precipitados. Luego se agrega permanganato de potasio. Observa las propiedades de cada sustancia.
¿Qué tipo de reacción química es, endotérmica o exotérmica?
¿Qué serán esas burbujas?
Analiza: La molécula del peróxido de hidrógeno es polar y está formada por dos átomos de hidrógeno y por dos átomos de oxígeno.
Es un agente oxidante, es decir, es una sustancia con tendencia a reducirse.
Es relativamente estable a temperatura ambiente, pero se descompone con facilidad incluso con la luz solar, por ello debe de guardarse en recipientes opacos.
Además de que numerosas sustancias actúan como catalizador de su descomposición, como los metales de transición, álcalis y óxidos metálicos.
Observa la ecuación química:
H2O2 (ac) → H2O (l) + ½ O2 (g) ΔH= - 196,4k J
¿Qué significa el triangulito?, y ¿por qué está la magnitud expresada en unidades de energía?
Observa con actividades experimentales estos procesos.
Pero antes se tiene que aclarar que para que se lleve una reacción química donde se rompen o forman enlaces químicos, se requiere de lo que se conoce como energía de activación.
Imagina que un día despiertas y tienes planeado hacer muchas cosas divertidas, sin embargo, suena tu despertador y piensas “otros cinco minutos más, necesito reunir un poco más de energía”.
Y te das un empujoncito para levantarte con toda la actitud, pues ese empujoncito que necesitas es la energía de activación. Es una reacción química y es como ese reto que debes superar para levantarte de la cama.
Es como cuando realizas ejercicio, para levantar las pesas necesita una cierta cantidad de energía de arranque. Las reacciones químicas requieren de cierta cantidad de energía para comenzar. Lo que se conoce como energía de activación, y se abrevia EA.
También es necesario tener presente este concepto clave, Entalpía.
Es el cambio de entalpía, el delta H, lo que indica la cantidad de calor que un sistema libera o absorbe a presión constante.
¿Recuerdas el triangulito que se observó en la reacción? El triangulito es una letra griega, se llama delta y representa la variación de la H, la cual representa la entalpía.
La entalpía es una magnitud termodinámica cuya unidad de medida es Joule.
Observa el siguiente gráfico. Muestra el desarrollo de una reacción exotérmica, es decir, que desprende energía, y una reacción endotérmica, la cual requiere energía.
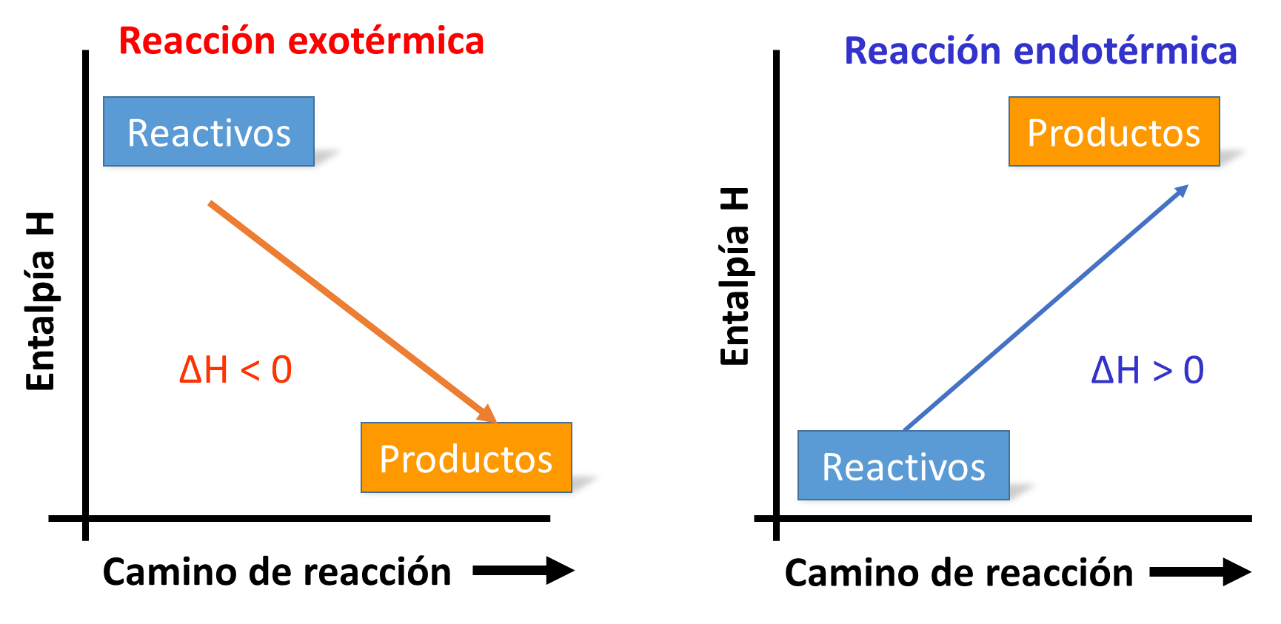
Si la entalpía es mayor a cero la reacción es endotérmica, eso quiere decir que absorbe calor. Puedes observar que tiene signo positivo.
Si la entalpía es menor a cero la reacción es exotérmica, desprende calor. Su valor de entalpia es negativo.
Con base en los siguientes ejemplos y con lo que acabas de aprender, determina si es una reacción endotérmica o exotérmica.
Observa la siguiente reacción:
- Un mol de dióxido de carbono con dos moles de agua, reaccionan obteniéndose una mol de metano y dos moles de oxígeno; el cambio de entalpía es de 890 kilo Joules.

Es una reacción endotérmica. - Cuando un mol de metano gaseoso reacciona con dos moles de oxígeno gaseoso para formar un mol de dióxido de carbono gaseoso y dos moles de agua líquida, el cambio de entalpía es de menos 890.4 Joule.
Si la entalpía posee un valor negativo es exotérmica.
Seguramente lograste identificarlas por el valor positivo o negativo de la entalpía con su símbolo Delta H.
Continúa experimentando para comprender mejor lo que son las reacciones endotérmicas y exotérmicas.
¿Qué necesitas?
- Vinagre
- Bicarbonato de sodio
- Una bolsa hermética
- Una servilleta
- Un vaso
- Una cuchara
- Un refractario o recipiente largo de plástico
Colocas la servilleta extendida, le agregas cuatro cucharadas de bicarbonato y doblas, posteriormente lo agregas a la bolsa plástica.
Cierras parte de la bolsa y dejas abierta una sección para verter el vinagre dentro de la bolsa que contiene el bicarbonato de sodio envuelto en la servilleta.
Inmediatamente después, cierras bien la bolsa y la colocas en el recipiente para observar qué es lo que sucede.
Se infló y se rompió.
Si tocas el líquido que resulta de la reacción se puede sentir una temperatura distinta; se enfría, dado que las reacciones endotérmicas absorben energía al reaccionar.
La bolsa se rompe porque la reacción entre el bicarbonato de sodio con el vinagre produce un gas conocido como dióxido de carbono y como es bastante, el gas hace que la bolsa se expanda y se rompa.
Es muy interesante comprender cómo sucede esta reacción, recuerda que cuando se origina una reacción química los enlaces de los reactivos se rompen produciendo que se reagrupen y formen nuevos enlaces para dar como resultado sustancias con nuevas propiedades químicas. Por ejemplo, en la reacción de descomposición del cloruro de hidrógeno, la diferencia de entalpía es de 92.3 kilo Joules.
Continúa experimentando.
¿Qué necesitas? Pero se aclara que la experimentación es demostrativa, por lo que no debes realizarlo en casa, para evitar que ocurra un accidente.
- Agua
- Hidróxido de sodio
- Un recipiente de cristal
- Termómetro
- Una varilla agitadora
¿Cómo lo haces?
En el vaso se vierte 100 ml de agua y con el termómetro se mide cuál es la temperatura.
Agregas una cucharada de hidróxido de sodio y mezclas con la varilla agitadora.
Procederás a medir la temperatura y notas que aumenta bastante.
En esta reacción se libera energía y eso se refleja en el incremento de temperatura. ¿Qué tipo de reacción es? Es exotérmica. Se llevó a cabo una actividad experimental demostrativa.
Ahora se requiere glicerina, permanganato de potasio y una rejilla. Coloca el permanganato de potasio sobre la rejilla, ahora colocas glicerina sobre el permanganato y observa qué es lo que ocurre.
Cómo puedes observar, esta reacción libera mucha energía. La glicerina es un líquido orgánico y el permanganato es un agente oxidante y cuando ambos entran en contacto se enciende espontáneamente. ¿Esta reacción química es endotérmica o exotérmica? Es exotérmica.
Observa el siguiente diagrama de flujo, revisa como se han colocado las palabras clave, en la parte de abajo están las definiciones de cada una de ellas, por ejemplo, la termoquímica, que se encarga del estudio de calor que sale o entra a un sistema debido a que sucede una reacción química.

El reto de hoy:
Si quieres conocer más acerca de este tema, se te sugiere “Calor y Movimiento” de Magdalena Rius y Carlos –Mauricio Castro.
Revisa la siguiente donde lo puedes consultar.
http://bibliotecadigital.ilce.edu.mx/sites/ciencia/volumen2/ciencia3/085/htm/calorymo.htm
¡Buen trabajo!
Gracias por tu esfuerzo.
*Este material es elaborado por la Secretaría de Educación Pública y actualizado por la Subsecretaría de Educación Básica, a través de la Estrategia Aprende en Casa.


Login to join the discussion