¿Qué regularidades identifico en la tabla periódica?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:11Aprendizaje esperado: Identifica la información de la tabla periódica, analiza sus regularidades y su importancia en la organización de los elementos químicos.
Énfasis: Explicar la valencia e identificar las regularidades de elementos químicos representativos, como el radio atómico, electronegatividad y energía de ionización.
¿Qué vamos a aprender?
Lee la siguiente frase célebre del químico Linus Carl Pauling:
“La satisfacción de la propia curiosidad es una de las mayores fuentes de felicidad en la vida.”
Conocerás la valencia e identificarás las regularidades de elementos químicos representativos como el radio atómico, electronegatividad y energía de ionización.
¿Por qué es importante la interpretación de la tabla periódica?
¿Sabías que el silicio se utiliza en diferentes industrias? En la construcción: es el componente principal de la arena con la que se fabrican ladrillos, hormigones, cementos y morteros. En cosmética: se utiliza en la fabricación de labiales, cremas humectantes, lacas para el cabello y protectores solares. En informática: se usa para los microchips, ya que es un buen conductor de la corriente eléctrica.
El silicio es el componente principal de las computadoras y teléfonos celulares.
Y aunque no es tan popular, el silicio es un elemento que está presente en nuestra vida cotidiana de una forma continua y silenciosa.
No olvides anotar en tu libreta las dudas o inquietudes.
¿Qué hacemos?
Alguna vez te has preguntado, ¿de qué estás hecho?, ¿sabes de qué están hechos los teléfonos celulares? ¿Qué contienen las baterías de un moderno automóvil eléctrico?
Por ejemplo, el ser humano está constituido por huesos, músculos, piel, sangre, cabello, uñas y tejidos, y los tejidos están constituidos por células, y éstas, a su vez, de biomoléculas.
Las biomoléculas están compuestas principalmente por elementos como el carbono, nitrógeno, oxígeno, azufre, hidrógeno y fósforo en su mayoría.
Estos elementos los encuentras en la tabla periódica, y la posición en que se encuentran dentro de ella te brinda la información sobre sus propiedades físicas y químicas y de la forma en la cual se relacionan con otros elementos.
Por ello es importante que identifiques la información que te brinda la tabla periódica, lo que te permite analizar la importancia de la organización de los elementos químicos representativos.
Los seres humanos siempre intentan dar una explicación a las situaciones complejas que se presentan. Los conocimientos químicos ayudan a explicar la complejidad de la materia que te rodea por medio de modelos, tablas y gráficas.
La tabla periódica es una herramienta básica para comprender la materia, ya que en ella encuentras respuestas a algunas interrogantes.
¿Sabes por qué la tabla periódica está ordenada en filas y columnas? ¿Qué información te da la tabla periódica?
Para conocer la respuesta, vas a aprender jugando con la tabla periódica. Antes de analizar los elementos, forma palabras o frases incluyendo los símbolos de la tabla periódica.
Observa algunos memes de frases con la tabla periódica de elementos.

Y aquí la fórmula del amor.

Efectivamente, el amor es pura química.
También puedes formar frases pretenciosas como esta:

¿Qué otras palabras o frases puedes formar? Pueden ser mensajes románticos o divertidos, o simplemente juegos de palabras.
Es una buena forma de introducirte al tema de los elementos.

¿Oye, y el calcio qué propiedades tiene? El número atómico del calcio es 20, tiene 2 electrones de valencia, por lo que se encuentra en el grupo 2, sus electrones están distribuidos en 4 órbitas, por ello, se encuentra en el periodo 4, presenta una coloración blanquecina y, a pesar de ser un metal, es extremadamente quebradizo.
La tabla periódica tiene la siguiente organización:
Los elementos químicos se organizan por el número atómico, en orden creciente de izquierda a derecha; recuerda que este número indica la cantidad de protones o cargas positivas, cuando el átomo es eléctricamente neutro, se tiene la misma cantidad de protones y de electrones, éstos tienen carga negativa. Como puedes observar en la tabla periódica, el hidrógeno es el elemento 1; el helio, 2; el litio, 3; berilio, 4; boro, 5; carbono, 6; nitrógeno, 7, y así sucesivamente.
Encontrarás de manera vertical 18 grupos, los cuales presentan las propiedades de los elementos que lo integran. Los elementos químicos representativos, que pertenecen a los grupos 1, 2, 13, 14, 15, 16, 17 y 18, tienen el mismo número de electrones de valencia; por ejemplo, los elementos que integran el grupo 1, sus átomos tienen un electrón de valencia; los del grupo 2, dos electrones de valencia; los del grupo 13, tres electrones de valencia y así sucesivamente.
La interpretación de la tabla periódica no sólo se enfoca en conocer la ubicación de los elementos químicos, sino también en sus propiedades y regularidades. Por ejemplo, la valencia, que se define como la capacidad de combinación que tienen los átomos de los elementos químicos, relacionada con el número de electrones de valencia, ubicados en la órbita más externa.
Los electrones de valencia tienen la función de formar las uniones entre átomos iguales o diferentes, y dependiendo del grupo (número de electrones de valencia) presentan la capacidad de donar, recibir o compartir electrones con átomos del mismo elemento o con otros elementos, asimismo, formar un determinado número de enlaces.
Por ejemplo, en el grupo 1 y 17 los átomos de los elementos representativos que los integran forman un enlace. En el grupo 1 los átomos de los elementos químicos tienden a donar su electrón de valencia, mientras que los elementos del grupo 17 reciben un electrón de valencia.
En el grupo 14, como los átomos de los elementos que integran este grupo tienen 4 electrones de valencia, pueden formar 4 enlaces al compartir electrones con otros átomos, tal es el caso del carbono.
En el grupo 15, los átomos de los elementos tienen 5 electrones de valencia, por lo que pueden formar tres enlaces al compartir electrones, por ejemplo, el nitrógeno.
En el grupo 16, los átomos de los elementos tienen 6 electrones de valencia, por lo que pueden recibir dos electrones, de manera que pueden formar dos enlaces, como lo pueden observar, en el oxígeno.
Recuerda que los electrones de valencia se pueden representar con base en la estructura de Lewis; observa en la imagen los enlaces que forman el amoniaco, el agua y el metano.

Por ejemplo, el grupo 2, integrado por berilio, magnesio, calcio, estroncio, bario y radio, cada uno de ellos en la órbita más alejada de su núcleo, tienen 2 electrones de valencia, por lo que tienden a donarlos, formando así dos enlaces.
De manera horizontal encuentras los periodos, el periodo que indica cuántas órbitas tiene cada átomo, por ejemplo, el periodo 1, una órbita; el periodo 2, dos órbitas, y así sucesivamente, es decir que los átomos del elemento sodio, al estar en el periodo 3, presentan tres órbitas.
Gracias a la posición de los elementos, encuentras la electronegatividad, la cual se define como la tendencia relativa de sus átomos para atraer los electrones de otros átomos con los que están enlazados.
Observa la siguiente tabla donde Linus Pauling estableció una escala asignada a los átomos de cada elemento químico. Observa con atención las flechas, ya que indican el orden creciente de electronegatividad.
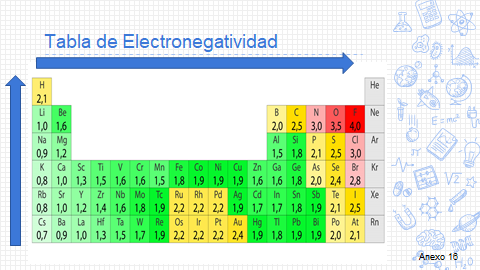
¿Cuál será el elemento más electronegativo?
La electronegatividad aumenta de izquierda a derecha y de bajo hacia arriba; esta magnitud es muy útil cuando se trata de predecir el tipo de enlace que formarán los átomos al unirse.
El elemento más electronegativo es el flúor, y muy reactivo, debido a esto forma compuestos con muchos elementos, en comparación con el francio, que es el elemento menos electronegativo.
Si suministras suficiente energía a un átomo neutro, éste podrá ceder o perder un electrón y obtener un ion positivo.
Un átomo neutro es cuando la cantidad de protones (carga positiva) y de electrones (carga negativa) es la misma.
Por ejemplo, en el caso del calcio, tiene el número 20, se encuentra en el periodo 4 y el grupo 2.
Si pierde los 2 electrones de valencia de la órbita 4, entonces se forma un ion, porque tiene 20 protones (carga positiva) y 18 electrones (carga negativa); en una suma algebraica, por lo tanto: +20-18=+2 (ion positivo).
Un ion es un átomo con carga, en este caso, positiva, a los iones con carga positiva se les llama cationes.
Como puedes observar en la imagen, la energía de ionización aumenta de izquierda a derecha y de abajo hacia arriba.
Las órbitas de los electrones no se pueden observar, pero sí predecir con base en las regularidades de los elementos químicos.
Lee el siguiente dato curioso de los elementos:
El Grafeno. Uno de los materiales del futuro, es ligero, resistente y conduce la corriente eléctrica mejor que cualquier elemento metálico. Su estructura bidimensional de átomos de carbono forma una red hexagonal y le confiere propiedades únicas que lo hace apreciado. En el campo de la industria tecnológica, la medicina o el medioambiente abre un amplio abanico de usos en diversos campos de investigación.
Ahora ya sabes que los electrones se encuentran en las órbitas que rodean al núcleo del átomo; esta región también es conocida como nube de electrones y no tiene un borde definido.
El límite externo de una nube de electrones se define como la superficie eléctrica en la cual existe 90% de probabilidad de hallar un electrón, sin embargo, esta superficie no existe de forma física, como en una pelota de golf, pero sí es útil para estimar el radio atómico de cada elemento químico.
Los elementos químicos no se encuentran aislados en el ambiente, pueden forman moléculas como el hidrógeno; para predecir el radio atómico de un elemento se calcula con la proximidad del otro elemento, es decir, la cercanía entre dos átomos de hidrógeno.
El radio atómico se define como la distancia del núcleo al borde indefinido de la nube de electrones.
Observa en la imagen de la tabla periódica la representación del radio atómico para cada elemento químico; de forma vertical, de arriba hacia abajo, aumentan los radios atómicos, y de forma horizontal, de derecha a izquierda, aumentan los radios atómicos.
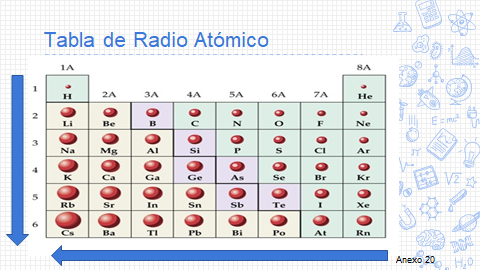
Para que comprendas mejor las regularidades y propiedades de algunos elementos químicos, realiza la siguiente actividad experimental.
Elabora una tabla en el cuaderno como la que se muestra a continuación.

Los materiales que vas a ocupar son:
- 6 platos de plástico
- Calcio, magnesio, yodo, cobre, aluminio, fósforo, sal yodatada
- Pila cuadrada nueva
- Foco led
- Cables delgados, puede ser de unos audífonos que ya no utilices, por ejemplo
Sigue con mucha precaución el siguiente procedimiento.
1. Con la ayuda de un adulto, retira las orillas del cable (debes tener 3 tiras, aproximadamente de 10 cm).
2. Une 2 tiras de cable con el extremo de la pila.
3. Une un cable con el led, el tercer cable únelo con el extremo del led.
Comprueba:
¿Qué sucederá si colocas los extremos de cable en el calcio?
No enciende el led; el calcio, a pesar de ser un metal debido a sus propiedades, no es buen conductor de la corriente eléctrica.
¿Qué sucederá con el cobre?, el cobre es un metal que conduce muy bien la corriente eléctrica.
Realiza la prueba con los otros materiales, observa lo que sucede y anota los resultados en la tabla.
Para analizar e interpretar la periodicidad de los elementos, organiza los bioelementos químicos (carbono, C; hidrógeno, H; oxígeno, O; nitrógeno, N; fósforo, F, y azufre, S).
Con base en las siguientes consideraciones:
a. Electrones de valencia (represéntalos con la estructura de Lewis).
b. Electronegatividad (de menor a mayor).
c. Energía de ionización (de menor a mayor).
d. Radio atómico (de menor a mayor).
Si es posible, comunica tus respuestas a la maestra o maestro de la asignatura de Ciencias, Química.
Aprendiste que la energía de ionización es inversamente proporcional al radio atómico. Recuerda que la energía de ionización es inversamente proporcional al radio atómico.
Si el radio atómico es muy grande, entonces los electrones ubicados en la última órbita o nivel de energía estarán más alejados del núcleo, por lo que es más fácil separarlos del átomo y, por lo tanto, será menor la energía de ionización.
A mayor valor de electronegatividad, indica que los átomos de un elemento dado tienen mayor atracción por sus electrones de valencia, por lo que, en un grupo, el valor de la electronegatividad disminuye a medida que aumenta su número atómico, es decir, a mayor distancia entre el electrón de valencia y el núcleo, mayor radio atómico.
En conclusión, la construcción del conocimiento de las regularidades de la tabla periódica te permite predecir los enlaces que pueden formar los elementos.
En el siguiente link puedes revisar la tabla periódica:
https://www.aev.dfie.ipn.mx/Materia_quimica/temas/tema3/items/infografia_u3.html
El Reto de Hoy:
Para seguir aprendiendo, puedes revisar la siguiente información.
Elementos de la tabla periódica
Y en: La química que tengo con ella
https://drive.google.com/file/d/1i4Gd-q5XUEl9NMEU0d5-_e54WW8JSh8f/view
Recuerda que la química está presente en distintas acciones de tu vida cotidiana, incluso cuando duermes y sueñas. Sigue construyendo con imaginación y creatividad la ciencia escolar.
Descarga tu clase dando clic
¡Buen trabajo!
Gracias por tu esfuerzo.


Login to join the discussion