¿Cómo representar los átomos?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:12
¿Cómo representar los átomos?
Aprendizaje esperado: identifica los componentes del modelo atómico de Bohr (protones, neutrones y electrones), así como la función de los electrones de valencia para comprender la estructura de los materiales.
Énfasis: reconocer los componentes del modelo atómico de Bohr y explicar la función de los electrones de valencia con la intención de comprender la estructura de los materiales.
¿Qué vamos a aprender?
Lee la siguiente frase célebre: “El aprendizaje es lo único que la mente nunca agota, nunca teme y nunca se arrepiente”. Leonardo Da Vinci.
Reconocerás los componentes del modelo atómico de Bohr y explicarás la función de los electrones de valencia con la intención de comprender la estructura de los materiales.
Los materiales que necesitarás son tu cuaderno, tu libro de texto, lápices y bolígrafos y tu quimiglosario.
¿Qué hacemos?
Analiza la siguiente situación:
¿Cómo le explicas a alguien qué son los átomos y para qué sirven los electrones de valencia?
Para entenderlo desde el mundo macroscópico, tendrás que entrar al mundo submicroscópico.
Ten en cuenta que todas las cosas y materiales están hechos de átomos.
Imagina que tienes unas cajas y descubrirás qué contienen.
En la primera caja hay átomos.
En la segunda caja. Átomos.
¿Qué hay en la tercera caja? Hay átomos.
¿En todas piensas que está hecho de átomos?
Empieza con la teoría atómica, donde se afirma que la materia está compuesta por unidades llamadas átomos.
Los griegos fueron los primeros en preguntarse de qué están constituidas las cosas introduciendo el concepto de átomo, cuyo significado es “indivisible”.
¿Cómo son los átomos?
Dalton a finales del siglo XIX propone:
- ANEXO2_Dalton
https://youtu.be/St5m6bO-2Uk?t=263
Del minuto 4:23 a 4:35
La materia se constituye de partículas mínimas, indestructibles e indivisibles llamadas átomos.
Los átomos de un mismo elemento siempre son idénticos entre sí.
En conclusión, todo está hecho de átomos, desde las cosas que puedes ver a simple vista como el sol. Hasta lo que no puedes ver a simple vista, como el coronavirus SARS-COV-2.
Eso quiere decir que no están mal las respuestas de las cajas, tú estás hecho de átomos, ellos están hechos de átomos, nosotros estamos hechos de átomos, eso está hecho de átomos. Pero ¿cómo son los átomos?
A lo largo de la historia algunos químicos se han hecho la misma pregunta.
Comienza con este video de Demócrito, es del siglo V antes de nuestra era y comparte la siguiente idea: - ANEXO3_Demócrito
https://youtu.be/St5m6bO-2Uk?t=336
Del minuto 5:36 a 5:44 - Modelo atómico de Dalton
https://youtu.be/St5m6bO-2Uk?t=345
Del minuto 5:45 a 5:57
Tuvieron que pasar más de 20 siglos para que la noción de átomo fuese aceptada. Dalton realizó la primera presentación científica del átomo en 1808.
En 1897, J J Thomson propone su modelo. - ANEXO5_Thomson
https://aprendeencasa.sep.gob.mx/multimedia/RSC/Documento/202105/202105-RSC-bdsm933yAN-Q3_B2_SEM35_PG3_170421_ANEXO5_THOMSON.pdf
Thomson, fue un físico británico, en sus publicaciones tiene esta de 1897, después de realizar su experimento de los rayos catódicos. - Anexo 6 Modelo de Thomson
https://youtu.be/St5m6bO-2Uk?t=375
Del minuto 6:15 a 6:23
De ahí su modelo atómico, mejor conocido como el budín con pasas. Afirma que el átomo se compone de electrones en un mar lleno de carga positiva. - ANEXO7_Rutherford
https://aprendeencasa.sep.gob.mx/multimedia/RSC/Documento/202105/202105-RSC-d5sJCmSaDn-Q3_B2_SEM35_PG3_170421_ANEXO7_RUTHERFORD.pdf
Rutherford hizo pasar un haz de partículas alfa a través de una laminilla muy delgada de oro.
Dedujo que la mayor parte del átomo está vacío y que existe una zona con carga positiva a la que llamó núcleo.
Realizó la siguiente observación: la mayoría de las partículas alfa atraviesan la lámina de oro sin sufrir ninguna desviación, entonces debía de haber espacios vacíos entre los átomos de oro.
Una de cada cuarenta mil partículas alfa, se desvían en un ángulo mayor de 90 grados en la lámina de oro, esto sugiere la existencia de un núcleo con carga positiva que provoca esta desviación.
Realiza esquemas de lo que estás aprendiendo, así como los que conocerás a continuación. - ANEXO8 Modelo de Rutherford
https://youtu.be/St5m6bO-2Uk?t=453
Del minuto 7:33 a 7:43
Observa que el centro del átomo está constituido por el núcleo, donde se encuentra la carga positiva a la que llamó protón.
James Chadwick hizo los mismos experimentos de Rutherford en 1932 y descubrió una partícula atómica con masa igual a la del protón y sin carga a los que llamó neutrones.
Pero Rutherford suponía que, si el electrón está cargado eléctricamente y se encuentra en movimiento constante, utilizará energía, lo que provocaría que ésta disminuya gradualmente hasta agotarse; entonces el electrón caería en el núcleo destruyendo al átomo, lo que no sucede y que este modelo atómico no podía explicar. - ANEXO 9 Bohr
El modelo atómico de Bohr propone órbitas o niveles energéticos en los que se encuentran los electrones.
Conoce de manera sencilla ¿qué es un átomo?
Imagina un estadio de futbol, ese sería tu átomo.
Al centro tienes la cancha y dentro de esta estaría el núcleo del átomo. Ahí colocarás este balón, que contiene protones y neutrones, es decir, el balón representa el núcleo de este átomo.
El estadio de futbol también tiene gradas, estas son circulares, pues tienen estas canicas que son los electrones que giran alrededor del núcleo.
Ahora borra todo y deja el balón y las canicas con la trayectoria circular.
Puedes imaginar la gran cantidad de espacio de este átomo está vacío.
Conoce el modelo atómico de Bohr.
Él retoma los experimentos de Planck y Kirckhoff y junto con la propuesta del modelo de Rutherford, propone el nuevo modelo compuesto por tres postulados.
Aplica para el átomo de hidrógeno en el átomo de hidrógeno el electrón gira alrededor del núcleo en órbitas o niveles energéticos.
Pero ¿cómo se distribuyen los electrones en los niveles de energía?
Cada elemento tiene cierta cantidad de protones, a este número se le conoce como número atómico y se representa con la letra z.
Ya que el átomo es eléctricamente neutro, puedes deducir que tiene el mismo número de electrones.
Por ejemplo, el sodio, su número atómico (z) es once, es decir, tiene once protones, y al ser neutro sabes que posee once electrones.
Recuerda que el átomo también tiene neutrones, que al sumarlos con los protones da como resultado el número de masa del elemento y se representa con la letra A.
Entonces, A es el número de masa, que es igual a la suma del número de protones y el número de neutrones de un átomo.
Piensa ¿cómo le harías para conocer el número de neutrones si conoces el número atómico y el número de masa?
Por ejemplo, el elemento sodio tiene los siguientes valores:
El número de masa A es 23.
El número atómico Z es once.
Entonces el número de neutrones es 12.
¿Sabías que? Los átomos son la unidad más pequeña de un elemento, están constituidos por protones, neutrones y electrones. Actualmente se han descubierto partículas aún más pequeñas llamadas quark y leptones.
Existen siete órbitas o niveles de energía en donde pueden situarse los electrones.
Estas órbitas o niveles de energía están numeradas del 1, que es la órbita que se encuentra más cercana al núcleo, al 7, que es la órbita más lejana al núcleo.
A continuación, conocerás la distribución de los electrones en los niveles de energía.
Los niveles energéticos también los puedes identificar por la letra mayúscula, 1 K, 2 L, 3 M, 4 N, 5 O, 6 P y 7 es Q.
En el primer nivel energético puede haber como máximo 2 electrones.
El segundo y tercero pueden tener hasta 8 electrones como máximo.
El cuarto y quinto hasta 18 electrones como máximo.
El sexto y séptimo puede tener como máximo hasta 32 electrones.
¿Y esto? ¿Para qué sirve?
Te sirve para poder representar a los átomos y las partículas subatómicas. Para saber cómo se pueden unir a otros átomos, es decir, cómo pueden formar enlaces químicos y comprender la estructura de los materiales; el diseño de nuevos materiales y el mejor aprovechamiento de los mismos.
Revisa el siguiente ejemplo:
Imagina que eres una empresa turística. El hotel se llamará hotel tabla periódica.
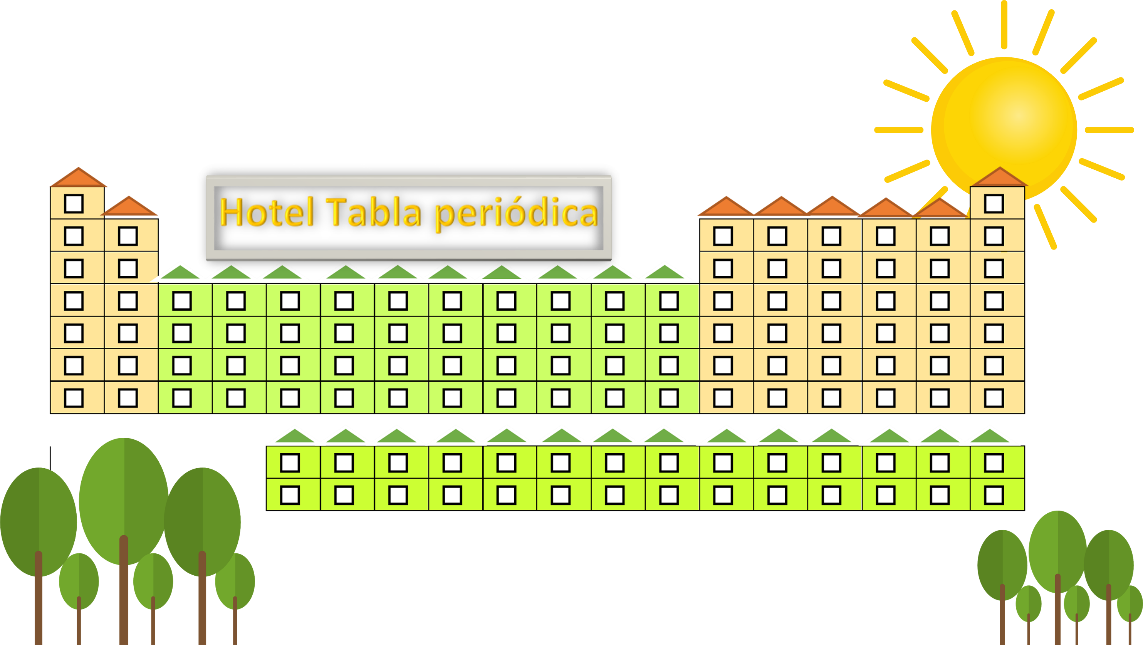
Tendrá 18 torres que equivalen a los grupos, con un máximo de 7 pisos o niveles, que corresponden a los periodos. Acomodarás a los huéspedes que son los elementos químicos de acuerdo con las propiedades y el modelo atómico de Borh de cada uno.
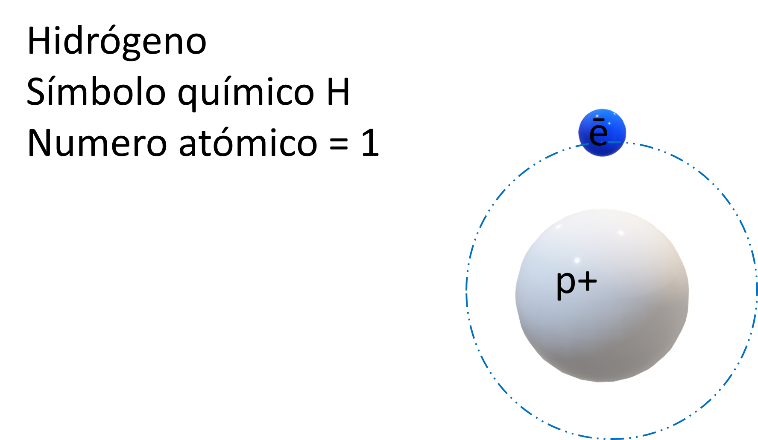
El primer huésped es el Sr. Hidrógeno, ¿cuál será su habitación?
Analiza cuál le corresponde de acuerdo con su modelo atómico y su número atómico, además de conocer cuáles son sus electrones de valencia, y por supuesto, cuántos niveles energéticos tiene.
El isótopo que recibes es el más común: el protio, posee un protón y un electrón.
¿Cuál es su número atómico? ¿en dónde lo acomodarías? Observa su modelo atómico.
De acuerdo con la tabla su nivel energético es el K; la tabla periódica está constituida por 18 grupos, que van del 1 al 18. Estas corresponden a los números de electrones que tienen en su última órbita. Observa en el hotel llamado tabla periódica que se muestra en la siguiente imagen.
Los pisos corresponden a los niveles energéticos, pero estos van de arriba hacia abajo. De acuerdo con esto. El hidrógeno se ubica en el primer piso o nivel energético, tiene un electrón de valencia, ¿en qué torre o grupo se podrá hospedar?
El hidrógeno se ubica en el grupo 1, solo tiene un protón. Grupo 1 primer nivel, ya que solo tiene una órbita. También llegan, helio, litio, berilio, boro, carbono, nitrógeno, oxígeno, flúor y neón.
Agiliza el proceso de recepción para acomodarlos en donde les corresponda. Recuerda que en la última órbita se encuentran el o los electrones de valencia, que al estar alejados del núcleo son los que se comparten o se ceden para formar los enlaces químicos.
El siguiente en llegar es el hidrógeno y después el helio. Analiza, tiene dos protones, dos neutrones y dos electrones. Por lo tanto, si tiene dos electrones, ¿cuántas órbitas podrá tener?
Una sola, recuerda que la tabla periódica, está conformada por 18 grupos que en esta analogía del hotel corresponden a las torres y 7 periodos que en esta analogía son los pisos.
Si tiene sólo dos electrones podría corresponder al grupo o torre dos, pero el caso del helio es muy particular, ya que es un gas noble.
Se dice que los gases nobles son inertes, es decir, no reaccionan con ningún otro elemento para formar compuestos.
Los gases nobles tienen ocho electrones en su último nivel energético, lo que les confiere gran estabilidad.
El único caso particular de la regla del octeto es para el primer periodo donde el helio es muy estable con sus dos electrones, esto porque sólo tiene una órbita o nivel energético.
Entonces, los huéspedes de ese grupo son, el neón, el argón, kriptón, xenón y radón. Por lo tanto, el helio, al pertenecer a los gases nobles por su estabilidad electrónica ocupa la torre 18 o grupo 18.
Elabora los modelos atómicos y esquematízalos en tu cuaderno. Coloca los electrones de valencia de esos elementos.
¿Quién sigue? El litio. Litio tiene 3 protones y 3 neutrones ¿Cuántos electrones tendrá? Tres. En el periodo 1 o K ya estaría ocupado por dos electrones, entonces sería K completo y L o periodo dos con un electrón. El modelo atómico queda de la siguiente manera.
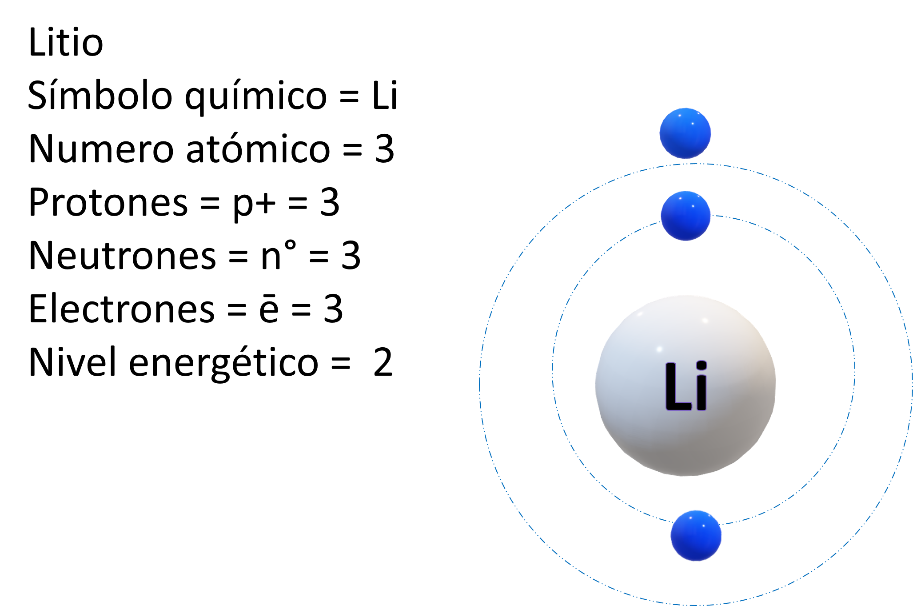
Seguramente lo acomodaste en el grupo 1 porque tiene un solo electrón de valencia, periodo dos, ya que tiene dos niveles energéticos u órbitas.
Recuerda cómo se obtiene su número atómico.
Z es igual al número de protones, y de acuerdo con el número de protones que cada elemento tiene, será el lugar que ocupe en la tabla periódica.
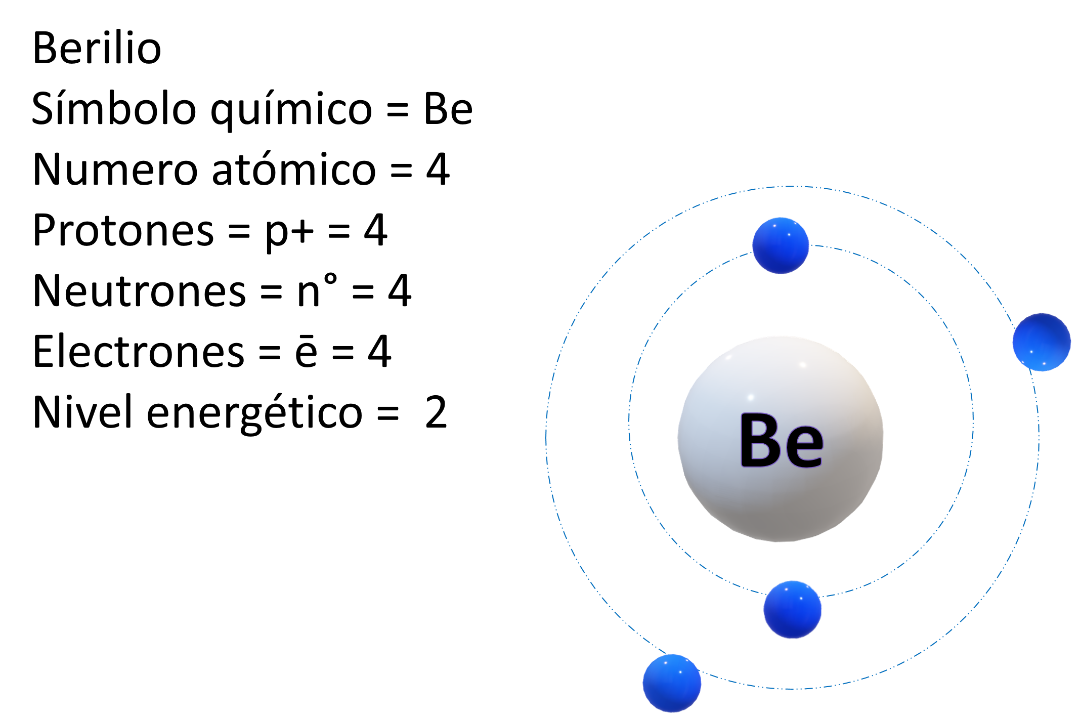
Ahora acomoda al berilio. Tiene 4 protones, entonces tiene dos órbitas, le corresponde el grupo dos, periodo dos porque tiene dos niveles de energía; observa su modelo atómico.
Ahora sigue con el boro, su modelo atómico y sale a vacacionar con sus electrones. Están distribuidos en dos órbitas, en la primera dos, y en la segunda, la más externa, tiene 3. ¿En dónde lo acomodarás?
Ocupará el periodo 2, en el grupo 13. Aquí se tiene que hacer una aclaración ya que tienes grupos para elementos representativos.
Son conocidos así, porque presentan regularidades, por ejemplo, en relación con su radio atómico.
En cambio, los elementos de transición tienen propiedades variables, se encuentran situados en la parte central de la tabla periódica, son diez grupos.
Es por ello que el boro es un elemento representativo, así que queda en el periodo 2 del grupo 13.
Hasta ahorita está sólo la mitad de los huéspedes.
Ya se realizaron todos los van en el periodo 2.
Para ubicar el grupo al que pertenecen los elementos químicos, tendrás que considerar el número de electrones de valencia.
Realiza los modelos atómicos de cada uno, así será más sencillo, recuerda el número máximo de electrones en cada órbita.
Continua con el carbono, tiene dos órbitas, seis protones, seis neutrones y seis electrones. En el primer periodo se colocan dos electrones, en el segundo periodo cuatro. Entonces corresponde al grupo de los elementos representativos, grupo 14, pues tiene 4 electrones de valencia en la capa más externa.
Acomoda al Nitrógeno, también tiene dos órbitas, en la externa donde están los electrones de valencia, tiene cinco, por lo tanto, se va al grupo 15.
Sigue el oxígeno, periodo dos, y tiene 2 electrones en el primer nivel y seis electrones de valencia en el segundo nivel, por lo que va en el grupo 16.
Ahora acomoda al flúor, es electronegativo. Tiene dos órbitas, en la última tiene 7 electrones de valencia, entonces se ubica en el grupo 17 en el periodo 2.
Falta uno, el neón. Como ya se mencionó, está completo. Tiene 8 electrones de valencia, entonces se ubica en el grupo 18 de los gases nobles. Solo falta el periodo, completo el primero y completo el segundo periodo.
Aunque podrías continuar si llegara una convención de elementos.
Recuerda que los electrones de valencia son los que participan en la unión entre los átomos, se le nombra como enlace químico.
El reto de hoy:
Se te recomienda un buen libro para esta sesión. Según los autores de este libro, si se ha habitado este planeta es indispensable conocerlo bien; para convivir mejor con él y en él.
La química ayuda a hacerlo, por lo que se recomienda: La Química terrestre de José Antonio Chamizo y Andoni Garritz Ruiz.
¡Buen trabajo!
Gracias por tu esfuerzo.


Login to join the discussion