¿Cómo asignamos el número de oxidación de elementos metálicos representativos?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:12
¿Cómo asignamos el número de oxidación de elementos metálicos representativos?
Aprendizaje esperado: relaciona el número de oxidación de algunos elementos con su ubicación en la tabla periódica.
Énfasis: relacionar el número de oxidación de algunos elementos metálicos representativos con su ubicación en la tabla periódica.
¿Qué vamos a aprender?
Lee la siguiente frase célebre de Michael Faraday:
“La química es necesariamente una ciencia experimental: las conclusiones se extraen de datos y sus principios son apoyados por la evidencia de los hechos.”
En esta sesión aprenderás a relacionar el número de oxidación de algunos elementos metálicos representativos con su ubicación en la tabla periódica.
Para ello conocerás actividades experimentales y modelos que te permitirán analizar el número de oxidación.
Con ayuda de la tabla periódica identificarás la relación que existe entre el grupo y el número de oxidación de algunos elementos metálicos representativos.
Para esta sesión necesitarás tu cuaderno, tu libro de texto de Ciencias III, lápiz, colores, bolígrafo y la tabla periódica de los elementos.
¿Qué hacemos?
Los números de oxidación son números enteros que representan el número de electrones que los átomos de un elemento ceden, ganan o comparten cuando forma un compuesto.
Los números de oxidación pueden ser positivos o negativos dependiendo de si el átomo del elemento cede o acepta electrones.
“Los números de oxidación te sirven para clasificar y balancear.
Una limitación de este modelo es suponer que los números de oxidación corresponden a las cargas de los átomos de los elementos que forman un compuesto”.
¿Sabías que el magnesio es importante para tu cuerpo, ya que ayuda a mantener una buena salud cardiovascular y ósea?
El aguacate, almendras, lentejas, quínoa, avena, por mencionar solamente a algunos alimentos, son muy ricos en magnesio.
El magnesio es un elemento químico. Se encuentra en el lugar número 12 de la tabla periódica de los elementos, es parte del grupo 2, período 3. Con esta información sabes que tiene 12 protones y 12 electrones que, según el modelo atómico de Bohr, en su órbita más cercana al núcleo, tiene 2 electrones, la siguiente 8 electrones y en la más alejada o externa 2 electrones. Es un metal de color plateado.
¿Para qué sirve conocer la cantidad de electrones externos?
Recuerda que en sesiones anteriores aprendiste sobre enlaces químicos, reacciones químicas, electrones de valencia, oxidación, reducción y modelos atómicos.
Lewis propuso un modelo donde solo se mostraban los electrones externos, el modelo cúbico.
Estos electrones, los llamados electrones de valencia son los responsables de la interacción entre átomos y la formación de enlaces químicos.
En esta sesión encontrarás conceptos clave con los que podrás realizar y diseñar un organizador gráfico para comprender mejor el tema.
¿Sabías qué? El óxido de magnesio, conocido como magnesia, es el segundo compuesto que abunda en el planeta y se emplea en la preparación de algunos antiácidos estomacales, para refinar ciertos metales, así como en la mezcla de algunos cementos.
El sulfato de magnesio hidratado fue descubierto por accidente en una granja del poblado británico de Epsom, cuyo propietario notó que su ganado vacuno rechazaba el agua extraída de un pozo local. También observó que aliviaba raspones y sarpullidos en la piel. Hoy siguen empleando sales de Epsom para curar lastimaduras cutáneas menores.
A continuación, conocerás una actividad experimental, para obtener el óxido de magnesio.
¿Qué necesitas?
- Lámpara de alcohol.
- Pinzas.
- Cinta de magnesio.
- Vidrio de reloj.
Se coloca la cinta de magnesio con las pinzas sobre la flama de la lámpara de alcohol, después de unos segundos ocurre un cambio. ¿Qué cambio crees que ocurrió?
Un destello de luz blanca, desprendimiento de un gas y un cambio de color ¿Piensas que, además de los cambios físicos han sucedido cambios químicos? ¿O también que haya cambiado algo en la estructura del magnesio?
Argumenta tus respuestas.
Los cambios que observaste son evidencia de que hay modificación en las sustancias iniciales.
El sólido blanco, lo que se formó fue óxido de magnesio.
El magnesio, al ser un metal, tiene pocos electrones de valencia.
Como se encuentra en el grupo 2 de la tabla periódica, tiene 2 electrones de valencia, cuando forma un compuesto, en este caso con el oxígeno, dona o cede sus electrones de valencia para tener estabilidad.
Al ceder los dos electrones de su órbita externa, se queda con 10 electrones.
Los átomos de los elementos tienden a la estabilidad ya sea en estado libre o formando compuestos.
El magnesio en estado libre tiene 12 protones o cargas positivas y 12 electrones o cargas negativas. Si haces la suma algebraica: 12 positivo más 12 negativo, da como resultado cero, es decir, que los átomos de los elementos son eléctricamente neutros.
Pero la cinta de magnesio formó un compuesto y para ello este elemento cedió sus 2 electrones de valencia, con la suma algebraica obtienes algo diferente.
12 protones o cargas positivas, más 10 electrones o cargas negativas, da como resultado 2 positivo.
Esto quiere decir que su número de oxidación es +2.
El número de oxidación es un número entero que representa el número de electrones que los átomos de un elemento pueden ceder, ganar o compartir cuando forma un compuesto.
El número de oxidación es positivo si el átomo pierde electrones o los comparte con un átomo que tenga tendencia a captarlos y negativo si el elemento acepta electrones.
Para asignar los números de oxidación, se siguen ciertas reglas las cuales son:
1.-Los átomos de los elementos libres tienen un número de oxidación de cero.
Esto se explica porque al no estar formando un compuesto no pierden ni ganan electrones. Por ejemplo: Magnesio, calcio, litio.
2.-Los átomos en un elemento molecular tienen un número de oxidación de cero, porque los electrones están compartidos de la misma forma. Por ejemplo: El oxígeno molecular, O2.
3.-Algunos elementos casi siempre tienen un número de oxidación con el que se les reconoce, independientemente del elemento con el que se combinan. Por ejemplo: Flúor -1.
4.- En algunos elementos representativos el número de oxidación es el del grupo al que pertenecen, por ejemplo, los elementos del grupo 1 tienen como número de oxidación +1.
5.- Los compuestos son eléctricamente neutros, por lo tanto, la suma algebraica de los números de oxidación de los elementos que lo forman da como resultado cero, por ejemplo: +2 del magnesio y -2 del oxígeno es igual a cero.
Esto quiere decir que el óxido de magnesio es un compuesto eléctricamente neutro.
Entonces, con la actividad experimental, se observa la oxidación del magnesio, que es una reacción química de óxido reducción también llamada redox, ya que los átomos de magnesio, al perder dos electrones, se oxidan y los átomos de oxígeno, al ganar los dos electrones, se reducen.
El aluminio es uno de los metales con mayor versatilidad y es usado con mucha frecuencia en la actualidad. Se puede encontrar hasta en un 10% de la corteza terrestre. Es extraído de minas para luego ser procesado y pasado por electrólisis y así obtener al elemento refinado con todas sus propiedades metalúrgicas.
El aluminio se utiliza con múltiples propósitos, por ejemplo: En el transporte, por su mejor rendimiento económico.
Actualmente se fabrican piezas fundidas de aluminio como rines, pistones, suspensiones e incluso las estructuras y carrocerías.
La ligereza del material supone un ahorro en combustible y no sólo eso, sino que en el sector aeroespacial ha hecho que, desde el primer aeroplano, sea un elemento indispensable en su construcción.
Analiza la siguiente actividad experimental.
¿Qué necesitas?
Sulfato de cobre.
Agua.
Recipiente de vidrio.
Un trozo de papel aluminio.
Sal como catalizador.
Recuerda que las actividades experimentales no las debes repetir en casa.
Identifica la posición de los elementos en la tabla periódica y, como con el magnesio, empieza a identificar el número de protones y electrones del aluminio de acuerdo con el número atómico.
Ahora, con base en su ubicación en la tabla periódica ¿Puedes saber el número de oxidación?
Primero se disuelve el cloruro de sodio y el sulfato de cobre.
En el recipiente de vidrio se coloca el papel aluminio y se vierte sobre él la disolución.
Existe un desprendimiento de un gas, un cambio de color.
Puedes representar simbólicamente lo que sucede mediante una ecuación química.
Al reaccionar el aluminio y el sulfato de cobre se produce el sulfato de aluminio y el cobre.
El aluminio tiene un número de oxidación +3 porque cede sus electrones de valencia, observa el modelo atómico y la tabla periódica para confirmar este dato.
En la tabla periódica encontrarás su número atómico, es 13, eso quiere decir que tiene 13 protones y 13 electrones; al encontrarse en el grupo 13 la información que te brinda es que tiene 3 electrones de valencia.
Se encuentra en el periodo 3 por lo que tiene tres órbitas, representa con el modelo de Bohr.

Pero al formar un compuesto dona sus 3 electrones de valencia para ser estable, por lo tanto, al hacer la suma algebraica 13 protones más 10 electrones da como resultado +3.
Represéntala simbólicamente.

El aluminio al reaccionar con el agua produce aluminio, hidrógeno molecular y el ion hidroxilo.
Aquí interviene el catalizador, la sal de cloruro de sodio.
El catalizador solo acelera la reacción, pero no interviene en la formación del compuesto.
La sal lo que hace es “levantar” el óxido del aluminio que es la capa de pasivación que lo protege.
El óxido de aluminio es un recubrimiento que tiene el papel para que no se oxide con agentes externos, y al quedar expuesto el aluminio puedes observar su oxidación y debido a esto, permite desplazar el hidrógeno del agua, por eso el agua de mar es tan corrosiva.
Eso quiere decir que: El papel aluminio en realidad tiene un recubrimiento de óxido de aluminio
Así es, lo que ocurre es que dicha capa de óxido actúa como una capa protectora para el resto del metal, haciendo que la corrosión no se extienda al interior de este.
La representación simbólica del óxido de aluminio es la siguiente:
Al reaccionar, el aluminio y el oxígeno se produce óxido de aluminio, observa la ecuación en la siguiente imagen.
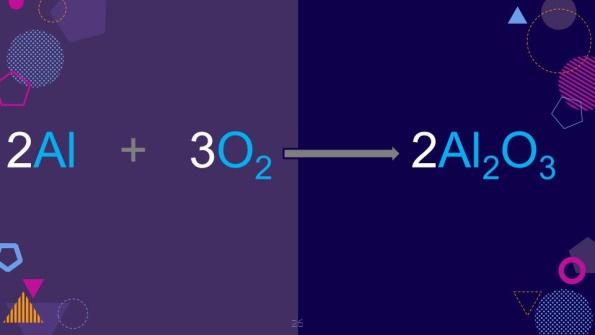
Los átomos de aluminio tienen 3 electrones de valencia que ceden al oxígeno, sin embargo, los átomos de oxígeno solo reciben 2 electrones, por lo tanto, se necesita otro oxígeno que recibe el electrón del aluminio, pero el segundo átomo de oxígeno necesita otro electrón para ser estable y encuentra a otro aluminio que le cede 1 electrón, este segundo átomo de aluminio cede los 2 electrones de valencia a otro átomo de oxígeno.
El oxígeno al tener 6 electrones de valencia necesita 2 electrones para alcanzar la configuración electrónica del gas noble más cercano y los acepta del aluminio, por eso se necesitan 2 átomos de aluminio y tres átomos de oxígeno para formar el óxido de aluminio.
Por lo tanto, la fórmula es Al2O3
La regla número 5 para asignar los números de oxidación dice que los compuestos son eléctricamente neutros, compruébalo.
Aluminio +3 por 2 átomos, es igual a +6 y el oxígeno tiene 3 átomos y debes obtener -6 para que la suma resulte en 0
¿Qué número de oxidación tiene el oxígeno? Es decir, ¿Qué número multiplicado por 3 te da -6?, 2.
Si sumas 6 positivo más 6 negativo, da como resultado cero, por lo tanto, este compuesto es eléctricamente neutro.
Realiza la siguiente actividad.
Completa los datos de los siguientes cuadros.

Con los datos del segundo cuadro realiza la suma algebraica para saber si los compuestos son eléctricamente neutros, primero multiplica el número de oxidación por el número de átomos.
Ahora realiza la suma algebraica para Li2S, posteriormente el de CaCl2.
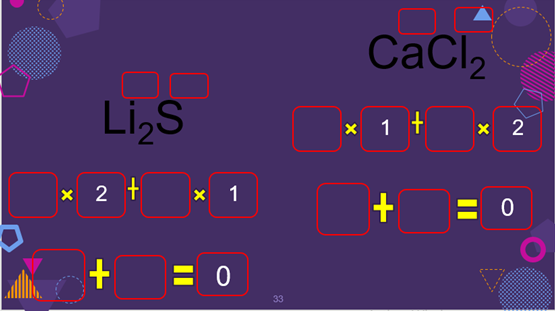
¿Los compuestos son eléctricamente neutros? Justifica tu respuesta.
En 1972 y 1973 respectivamente la NASA lanzó al espacio las sondas Pioneer 10 y 11, que formaron parte de un programa no tripulado para la exploración planetaria, dos afamados científicos, Carl Sagan y Frank Drake convencieron a la NASA para que se portaran placas con información sobre nuestro planeta, estas placas se fabricaron con aluminio 6061, una aleación que se usa para construir trenes, barcos o tuberías.
En esta sesión reconociste que la información que proporciona la tabla periódica es de mucha importancia para entender la formación de compuestos.
Ahora sabes que los números de oxidación son números enteros que representan el número de electrones que los átomos de un elemento ceden, ganan o comparten cuando forma un compuesto.
Los números de oxidación pueden ser positivos o negativos dependiendo si los átomos del elemento ceden o aceptan electrones. Sirven para clasificar o balancear.
Existen reglas para asignar los números de oxidación en los elementos.
Una limitación de este modelo es suponer que los números de oxidación corresponden a las cargas de los átomos de los elementos que forman un compuesto.
El reto de hoy:
Consulta la tabla de los elementos químicos en la siguiente dirección electrónica:
¡Buen trabajo!
Gracias por tu esfuerzo.
Para saber más:
Lecturas


Login to join the discussion