¿Cómo represento las reacciones químicas?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:12¿Cómo represento las reacciones químicas?
Aprendizaje esperado: representa el cambio químico mediante una ecuación e interpreta la información que contiene.
Énfasis: representar reacciones químicas mediante ecuaciones y modelos a fin de interpretar la información que contienen.
¿Qué vamos a aprender?
Para iniciar considera la siguiente frase de Julieta Fierro, astrónoma, investigadora del Instituto de Astronomía de la UNAM y divulgadora científica mexicana:
“La ciencia trata de hacer las cosas muy sencillas para poder entender a la naturaleza.”
¿Sabías qué…? El escarabajo bombardero produce dos sustancias químicas (peróxido de hidrógeno e hidroquinona) y varias enzimas en glándulas separadas que se ubican bajo su abdomen.
Para defenderse de sus depredadores, el insecto excreta dichas sustancias en otro compartimento donde reaccionan y producen una mezcla irritante que lanzan con fuerza contra su agresor; esa reacción química alcanza una temperatura de 100º Celsius.
Además de tu habilidad de observación y toda tu atención, los materiales que vas a necesitar para el desarrollo de las actividades son:
- Libro de texto
- Bitácora científica, que es el cuaderno de la asignatura.
- Bolígrafos
- Colores
- Pelotas de esponja
- Palillos
¿Qué hacemos?
¿Por qué lloras cuando partes la cebolla? La culpa es de esta cebolla
La cebolla es un ingrediente esencial en la cocina. Cuando está entera no hay ningún problema, pero al cortarla, el cuchillo rompe multitud de células que ocasiona que varias moléculas, que normalmente se encuentran separadas en las células, se mezclen, y entren en contacto con el aire.
Dentro de sus células las cebollas presentan compuestos que tienen azufre. Al romper las células con el cuchillo, dichos compuestos sufren una reacción química debido a una enzima llamada alinasa que los transforma en moléculas sulfuradas volátiles que son liberadas al aire.
Este compuesto se conoce como factor lacrimatorio y es el responsable de la irritación de los ojos.
Este compuesto sulfurado reacciona con la humedad de los ojos, produciendo una sensación de quemazón.
Las terminaciones nerviosas en los ojos son muy sensibles y detectan esta irritación. Entonces, el cerebro reacciona transmitiendo mensajes a los conductos lagrimales de los ojos para que produzcan una mayor cantidad de agua, es decir, más lágrimas, de manera que se diluya el ácido y proteger así los ojos.
¿Esto se debe a una reacción química? ¿cómo se podría representar?
Antes de querer representar una reacción química, será necesario entender, que las reacciones químicas (también llamadas cambios químicos o fenómenos químicos) son procesos termodinámicos de transformación de la materia.
En estas reacciones intervienen dos o más sustancias (reactivos o reactantes), que cambian significativamente en el proceso, y pueden absorber o liberar energía para generar dos o más sustancias llamadas productos.
Algunas características de las reacciones químicas son:
- Altera la estructura y composición de los átomos de las sustancias iniciales.
- Produce sustancias nuevas.
- Pueden darse de manera espontánea en la naturaleza o pueden ser producidas por los seres humanos en un laboratorio bajo condiciones controladas.
- Muchos materiales de uso cotidiano son producto de reacciones químicas.
Esta es una reacción química y se estudiará su representación mediante ecuaciones químicas.
Dicho lo anterior, se puede definir una ecuación química como una representación, mediante símbolos y fórmulas, de los cambios ocurridos en el transcurso de una reacción química.
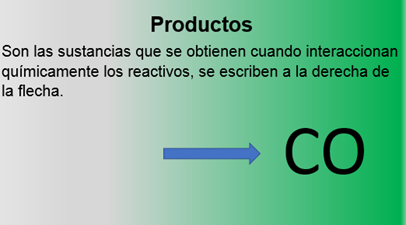
La información que contiene una ecuación química es muy valiosa porque nos permite conocer lo que sucedió en una reacción o predecir lo que va a ocurrir. Observa:
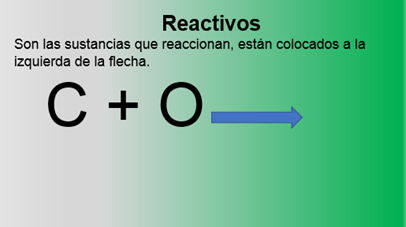
Reactivos: son las sustancias que reaccionan, están colocados a la izquierda de la flecha, también se les llama reactantes o sustancias iniciales.







También se necesita saber que el número de átomos de cada elemento se obtiene al multiplicar el coeficiente por el subíndice.
Antes de representar una reacción, será necesario entender que en la química se utilizan modelos de las sustancias para explicar su comportamiento químico y físico. La forma en que se presentan estas estructuras aporta información valiosa, por ejemplo, el número de átomos del mismo elemento y su estructura tridimensional.
Una sustancia puede ser representada de diferentes formas, con su fórmula química, con una estructura plana bidimensional o mediante una estructura tridimensional.
¿Cuál es la más eficaz? Depende de la información que te interese. Si sólo necesitas saber el tipo y el número de átomos que tiene una sustancia, será suficiente con observar la fórmula; si además te interesa la forma en la que se unen estos átomos, habrá que recurrir a la estructura, por ejemplo, el modelo de Lewis, y si requieres saber la orientación relativa de los átomos en el espacio, puedes observar la estructura tridimensional de las moléculas.
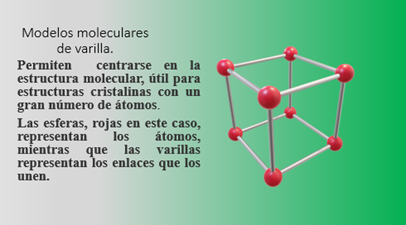
Para facilitar la comprensión de las interacciones entre átomos, en el ámbito de la investigación científica se ha recurrido a la construcción de modelos moleculares tridimensionales.
Ensamblando convenientemente bolas y varillas hechas con diferentes materiales, se pueden construir representaciones a escala de todo tipo de moléculas.
La construcción y manipulación de estos modelos moleculares resultó ser una herramienta fundamental en muchos de los avances en el estudio de la estructura de las macromoléculas en la segunda mitad del siglo XX.
En la actualidad existen aplicaciones informáticas que permiten desarrollar y manipular virtualmente modelos moleculares tridimensionales.
Los modelos más utilizados para la representación de moléculas en química son:

En 1865, el químico alemán August Wilhelm Von Hofmann fue el primero en crear los modelos moleculares de barras y esferas. Usó los modelos en una conferencia para enseñar, mediante cursos de conferencias filosóficas y experimentos, la aplicación de la ciencia en la vida común.
Los colores juegan un papel muy importante para diferenciar cosas similares. En el caso de los modelos moleculares existe un código de colores. Por ejemplo, el carbono siempre es de color negro o gris. Esto no es una casualidad; los modelos moleculares se ciñen a unos colores que puedes considerar estándar, y que también reciben el nombre de colores CPK (Corey, Pauling y Koltun, que fueron los pioneros en la creación de los modelos moleculares). Así, centrándote únicamente en los más habituales.
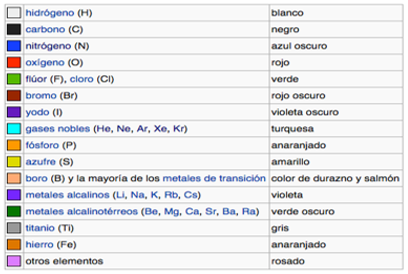
Entonces, en general las bolas de distintos colores representan átomos de distintos elementos químicos en una molécula, mientras que las barras representan los enlaces entre ellos.
En general, estos modelos moleculares son bastante útiles para observar lo que ocurre durante una reacción química: cómo se rompen los enlaces de los reactivos y se forman enlaces nuevos en los productos.
Para obtener mayor información sobre los modelos tridimensionales y lo sencillo que es hacerlos en casa, observa el siguiente video del minuto 2:53 a 8:27:
- ¿Modelos de moléculas?
Has conocido distintos modelos para representar las moléculas, cada uno proporciona cierta información, por lo que se puede decir que se complementan para representar lo qué no se puede ver a simple vista.
Ubica las partes de la ecuación química con un ejemplo, te apoyarás con modelos elaborados con pelotas de esponja y palitos de madera Tienes que la fórmula del agua es H2O, entonces quiere decir que, para formarse esta molécula, se tuvieron que combinar 2 átomos de hidrógeno con uno de oxígeno. Esto se puede representar así:
Hidrógeno más oxígeno produce agua.
Con ayuda de la tabla periódica, vas a sustituir los nombres por los símbolos de estos elementos, así como la fórmula del agua y queda:
H(g) + O(g) produce H2O(l).
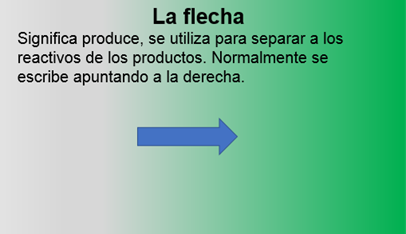
Como la flecha significa produce, entonces
H(g) + O(g) H2O(l).
Como el hidrógeno y el oxígeno son gases, se encuentran como moléculas diatómicas:
H2 (g)+ O2(g) H2O (l)
Ya que se planteó la ecuación, verifica que la misma cantidad de átomos que agregaste al inicio coincida con los que se obtienen al final, para cumplir con la ley de la conservación de la materia, por lo tanto, la ecuación queda de la siguiente manera:
Cuatro átomos de hidrógeno gaseoso al combinarse con dos átomos de oxígeno producen dos moléculas de agua en estado líquido. Por último, cuenta el número de pelotas que utilizaste al inicio y cuántas utilizaste al final, con esto compruebas que la cantidad de masa es la misma al principio y al final de la reacción química.
2H2 (g)+ O2(g) 2 H2O (l)
Ya que tienes la ecuación definida, procede a identificar cada una de sus partes y comienza con:
Los reactivos: H, O
Los productos: H2O
Coeficientes en reactivos:
H = 2
O = 1
Coeficientes en productos
H2O = 2
Subíndices en reactivos:
H = 2
O = 2
Subíndices en productos:
H = 2
O = 1
Representarás otra ecuación química para identificar cada una de sus partes, de acuerdo con lo que se mencionó anteriormente. Esta ecuación se lee: dos átomos de hidrógeno gaseoso reaccionan con dos átomos de cloro gaseoso y producen dos moléculas de ácido clorhídrico gaseoso.
H2 (g) + Cl2(g) 2HCl(g)
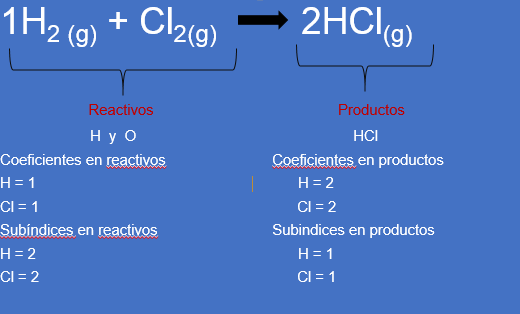
Los reactivos son: H2 + Cl2
Los productos obtenidos: 2 moléculas de HCl o ácido clorhídrico.
Observa los coeficientes en reactivos:
En el H = 1 aunque en química los unos no se escriben, solos en esta ocasión se van a colocar, pero, es importante que recuerdes esta indicación.
En el cloro Cl = 1
Ahora identifica los coeficientes en productos
HCl = 2
Subíndices en reactivos
H = 2
Cl = 2
Subíndices en productos
H = 1
Cl = 1
Finalmente determina el número de átomos multiplicando el coeficiente con el subíndice en reactivos:

Realiza la comparación de número de átomos y observa que existe el mismo número de átomos de hidrógeno y cloro en reactivos y en productos, esto permite demostrar la ley de la conservación de la materia.
Datos de la Asociación Dental Mexicana (ADM) estiman que entre el 70 y 90% de los mexicanos padecen caries dental, es decir, 9 de cada 10 mexicanos tienen caries.
La formación de la caries es una reacción química, el esmalte de los dientes tiene un espesor aproximado de 2 mm y contiene 98% de hidroxiapatita, que es insoluble en agua. Sin embargo, pequeñas cantidades se disuelven en la saliva mediante un proceso químico llamado desmineralización.
Realiza la siguiente actividad, completa la tabla escribiendo cuales son los reactivos, productos, coeficientes y subíndices de las ecuaciones que aparecen.
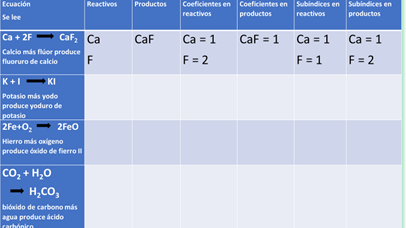
Observa el ejemplo: En esta ecuación química se tiene que el calcio Ca más flúor F produce fluoruro de calcio CaF y se lee un átomo de calcio más dos átomos de flúor producen una molécula de fluoruro de calcio.
Los reactivos son calcio y flúor, anota solo los símbolos químicos. En productos ves que se formó fluoruro de calcio. Los coeficientes en reactivos, se tiene un átomo de calcio y dos de flúor, el coeficiente de los productos es uno.
Los subíndices en reactivos son: uno para el calcio y uno para el flúor. Por último, los subíndices en productos son: uno para el calcio y dos para el flúor.
Durante este tema también utilizaste tus conocimientos de matemáticas y física para poder entender las ecuaciones químicas, que contienen información útil para entender el mundo
La química de la odontología. La química juega varios papeles en la odontología desde ayudar a prevenir el deterioro de los dientes hasta blanquearlos.
Las pastas de dientes que contienen flúor, normalmente en forma de fluoruro de sodio, pueden ayudar a prevenir la caries disminuyendo las reacciones químicas que la producen.
El reto de hoy:
Conoce otras cosas interesantes sobre la química. En los libros de la biblioteca del Aula podrás encontrar el libro “Moléculas en una exposición”, de John Emsley. En él encontraras explicaciones sobre las propiedades de las moléculas y sus usos.
Para buscar un poco de acción, busca ¡La culpa es de las moléculas! de Faustino Beltrán con el que podrás construir dispositivos para experimentar y descubrir secretos de la naturaleza.
¡Buen trabajo!
Gracias por tu esfuerzo.
Para saber más:
Lecturas



Login to join the discussion