¿Cómo representamos la unión entre átomos?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:12¿Cómo representamos la unión entre átomos?
Aprendizaje esperado: representa el enlace químico mediante los electrones de valencia a partir de la estructura de Lewis.
Énfasis: representar el enlace químico con la estructura de Lewis considerando la compartición y transferencia de electrones.
¿Qué vamos a aprender?
“Nada en la vida es para ser temido, es sólo para ser comprendido. Ahora es el momento de entender más, de modo que podamos temer menos”.
Esta es una frase de Marie Curie. La primera mujer galardonada con el Premio Nobel de Química, en 1903.
Te das cuenta de que el conocer y el aprender te ayuda a comprender y tener menos temores. ¡Así que entiende más y teme menos!
En esta sesión representarás el enlace químico con la estructura de Lewis, considerando la compartición y transferencia de electrones.
Asimismo, comprenderás cómo es que los átomos de los elementos son capaces de formar uniones, ya sea con otros átomos del mismo elemento o diferentes elementos, es decir, cómo se forman los enlaces químicos.
Los representarás, por medio de la estructura de Lewis, tomando en cuenta el número de electrones de valencia de los átomos de los elementos en los diferentes grupos de la tabla periódica.
¿Qué hacemos?
Sabías que los neurotransmisores son las sustancias químicas que actúan como mensajeros de la información, y ésta la pasan de una neurona a otra. Ejemplos de neurotransmisores son: la dopamina, la serotonina y oxitocina, que se producen cuando te enamoras, éstas son las responsables de que te sientas con energía, y que tu percepción de la vida sea magnífica.
Para continuar con esta felicidad, recuerda lo que utilizarás en esta sesión:
- Lápices,
- colores,
- un foco led,
- un cable de cobre,
- dos papas,
- vinagre,
- clavos galvanizados,
- dos monedas de cobre,
- dos cables conectores con pinzas de cocodrilo,
- una charola para hacer hielos,
- una lata de cualquier bebida gaseosa.
¿Qué vas a hacer con esos materiales?
Vas a prender el foco, y pensarás que para eso se necesita un contacto y una corriente eléctrica. Pero ahora en lugar de la corriente eléctrica, utilizarás como fuente a la química haciendo una celda electroquímica.
Lo primero que harás es a cada clavo enrollarle un tramo de alambre de cobre. Lo alternarás en la charola para hacer hielos de la siguiente forma:
Debes procurar que quede un pedazo de cobre en un espacio y uno de zinc. Pero, ¿de dónde sacas el zinc? Del galvanizado de los clavos está compuesto por zinc.
Posteriormente, agregarás el vinagre procurando que no se desborde de cada contenedor, de lo contrario, no va a funcionar.
Un voltímetro: Es un instrumento de medición para saber cuántos volts tiene de corriente eléctrica.
Con él, puedes a demostrar que tiene una corriente eléctrica.
¿Qué es la corriente eléctrica? Es la circulación de electrones a través de un material conductor que se mueve de un polo negativo a un polo positivo de la fuente de suministro.
Con un foco led, acércalo, teniendo cuidado de que cada extremo o patita, es decir, las terminales eléctricas, queden en cada compartimiento. ¿Consideras que va a encender? Y ¿si le pones una bocina pequeña?, ¿Crees que funcione con las papas?
Anota en tu libreta. ¿Por qué crees que funcione?
Comprueba tu respuesta.
Introduce el clavo galvanizado en el centro de la papa. Luego presiona el clavo hacia el interior. Necesitas la moneda de cobre, colócala a una distancia de 2.5 cm del clavo.
Repite estos pasos con la otra papa. Asegúrate de que la moneda y el clavo no choquen en el interior.
Conecta las dos papas por medio de un cable con pinza cocodrilo. Si no tienes o consigues sólo enrolla el cable en cada uno de los extremos.
Conectarás cada papa al voltímetro para registrar si hay una corriente eléctrica.
Ahora conecta las dos papas por medio de un cable con pinza cocodrilo, en una papa con la moneda y la otra con el clavo.
Conecta a la parte positiva el que está unido a la moneda, tiene un signo más (+), ese es el lado positivo.
Conecta el segundo cable que corresponde al clavo de la terminal negativa (-). Funciona.
Ahora realízalo, con la bebida gaseosa. Sólo que ahora aprenderás otra forma de hacer una celda, sólo replica en tu casa el modelo, pon en juego tu creatividad para que pueda funcionar.
¿Por qué funciona? Lo que acabas de hacer se llaman celdas electrolíticas, a lo que comúnmente se les conoce como pilas.
Éstas empujan los electrones hacia el cátodo, por lo que éste tiene signo negativo, y los toma del ánodo por lo que éste es positivo.
Las papas contienen ácido fosfórico, el cual sirve como una disolución química necesaria para transferir electrones de un lado a otro entre dos placas de metal.
Como has estudiado en sesiones anteriores, los átomos están constituidos por partículas subatómicas, protones, neutrones y electrones.
Los electrones que ocupan los niveles más altos de energía, los que se encuentran más alejados del núcleo, se llaman electrones de valencia y son los que participan en la formación de enlaces químicos.
¿Cómo se unen los átomos de los elementos con otros átomos de igual o diferentes elementos?, ¿Cómo es que se mantienen unidos los átomos en las moléculas de elementos y compuestos?
Por medio de enlaces, se parecen a los enlaces matrimoniales, ya que los enlaces químicos mantienen unidas a las moléculas.
Los que se comparten, se ganan o se pierden se llaman: electrones de valencia.
Ahora que sabes más sobre la tabla periódica, realiza un pequeño repaso acerca de la información que puedas obtener de ella.
Observa la tabla periódica:
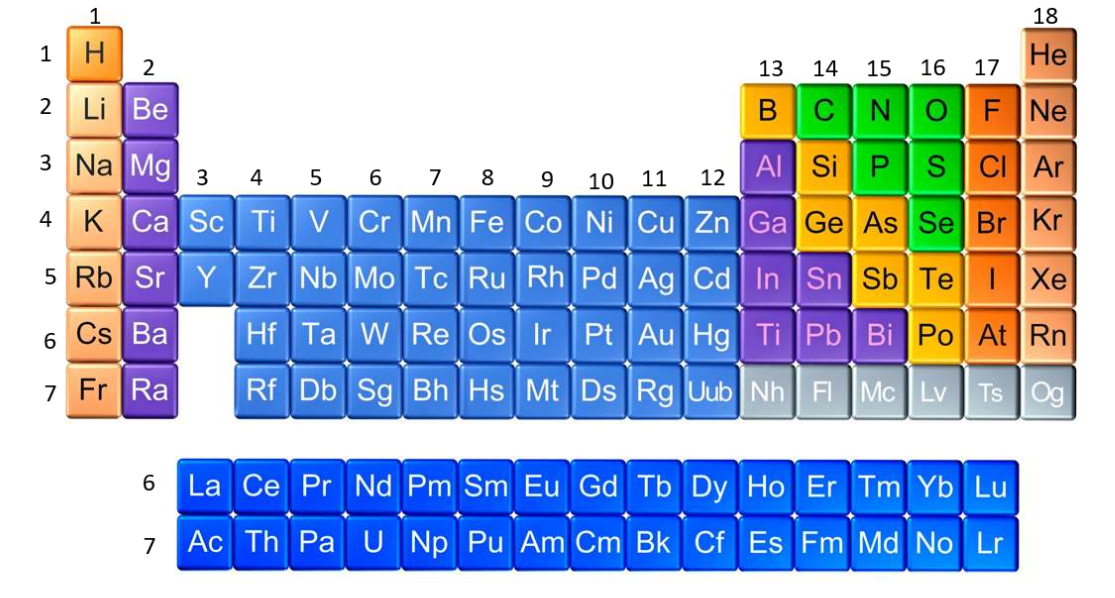
Ubica los periodos y grupos. Estos te ayudan a ubicar un elemento en particular.
Esto quiere decir que, a cada elemento químico le corresponde un lugar único en la tabla periódica.
¿Cuántos periodos tiene?, estos corresponden a un ordenamiento horizontal, es decir a las filas. Los elementos de cada periodo tienen diferentes propiedades, pero tienen la misma cantidad de órbitas o niveles de energía.
Son 7, te das cuenta de que corresponde a las órbitas o los niveles de energía donde pueden situarse los electrones, la primera órbita o nivel de energía es la más interna o cercana al núcleo y la séptima la más externa o alejada del núcleo.
¿Cuántos grupos hay? Si los periodos son las filas entonces los grupos son las columnas. Sus elementos tienen una disposición similar de los electrones de valencia.
Anteriormente, los grupos de la tabla periódica se expresaban con un número romano, seguido de la letra A o B mayúscula con base en sus propiedades.
¿Qué elementos se expresaban con la letra A? A los elementos que presentan regularidades en sus propiedades, están situados en los extremos de la tabla periódica, se les nombra elementos representativos.
¿Qué elementos se expresaban con la letra B? Se les conoce como elementos de transición, porque sus propiedades varían en función de los electrones de valencia.
Los elementos de transición se ubican en el centro de la tabla periódica entre los elementos metálicos de los grupos 1 y 2, que son altamente reactivos, y los elementos no metales de los grupos 13 al 17.
Actualmente los grupos se nombran de izquierda a derecha, con números arábigos del 1 al 18.
Dato curioso. Seis elementos químicos son estables sin necesidad de compartir, ceder o ganar electrones de valencia, a éstos se les conoce como gases nobles o inertes porque es muy poco probable que reaccionen con átomos de otros elementos.
Los gases nobles o inertes son el helio, neón, argón, kriptón, xenón y radón. Los gases nobles son aprovechados como fuentes de luz y en rayos láser.
Consulta la tabla periódica, la puedes revisar de una página electrónica o localiza la que está en tu libro de texto.
¿Cómo puedes saber cuántos electrones de valencia tienen los elementos?
Si analizas la información de la tabla periódica que se relaciona con las propiedades de los elementos químicos, te va a ser fácil predecir la formación de compuestos.
¿Cuántas columnas tiene la tabla periódica? Tiene 18 columnas.
Para el análisis de los elementos representativos, centrarás tu atención en los grupos 1, 2, y del 13 al 18.
Anteriormente, en la tabla periódica los elementos representativos se nombraban con números romanos del I al VIII y con una letra A.
Ahora bien, los elementos del grupo 1 tienen un electrón de valencia, los del 2 tienen 2 electrones de valencia, los del grupo 13, cuentan con 3 electrones de valencia, los elementos del grupo 14, ¿cuántos electrones de valencia tendrán?
Tienen 4 electrones de valencia.
Y así consecutivamente hasta llegar al número máximo de electrones de valencia que puede tener un átomo, ¿Sabes cuál es ese número máximo de electrones de valencia que puede tener un átomo?
Exactamente, son 8. Este número coincide con el número romano que se mencionó anteriormente. La regla del octeto te indica que los átomos comparten electrones, de modo que buscan ser más estables con 8 electrones.
¿Cómo expresar los electrones de valencia en la estructura de Lewis? Puedes saber fácilmente el número de electrones de valencia de los átomos de un elemento representativo fijándonos en el grupo de la tabla periódica al que pertenece.
Pero antes coloca el símbolo del elemento.
Por ejemplo, el número atómico 1 ¿a qué elemento corresponde? Al hidrógeno.
¿Cuántas órbitas tiene? Una.
¿A qué grupo pertenece? Al grupo uno 1.
El modelo corpuscular del hidrógeno, en el centro tiene su símbolo químico. ¿Cuántos electrones de valencia tiene? Si pertenece al grupo 1 entonces tiene un electrón de valencia. Eso significa que, al unirse los átomos del hidrógeno con otros átomos, comparten un par de electrones, pues tiene un electrón de valencia para formar un enlace.
¿Qué pasa con los elementos del grupo dieciséis? Toma como ejemplo al oxígeno. Su símbolo químico es una O mayúscula. Localiza a qué grupo pertenece el oxígeno. Al 16, por lo tanto, tiene seis electrones de valencia, comienza a colocarlos como si fuesen puntos cardinales y en sentido de las manecillas del reloj.
Arriba el primero, a la derecha el segundo, el tercero abajo, el cuarto a la izquierda.
¿Cuántos faltan por colocar? Porque así quedaría como el grupo 14, por ejemplo, el carbono.
Dos. Así dónde los colocas, en el caso del oxígeno los colocas arriba y abajo. ¿Observas que forman pares?, ¿Así podrás formar enlaces químicos? Recuerda que se mencionó que se parecen a los matrimonios.
En México no se pueden formar enlaces con quien ya tiene pareja, pues lo mismo pasa aquí, los electrones que tienen pareja no pueden formar nuevos enlaces, pero sí con los que están solitarios o solteros.
En este caso, ¿cuántos electrones de valencia quedan libres? Dos.
El oxígeno tiene dos electrones que compartir. ¿Y si haces la estructura de Lewis del Cloro?
Hazlo en tu libreta. ¿Recuerdas el paso número uno?, ¿Cuál es?
Busca a qué grupo pertenece. Pertenece al grupo 17. Coloca el símbolo químico.
¿Cuántos electrones de valencia tiene? Siete.
Coloca puntos o cruces de uno en uno, empezando en sentido de las manecillas del reloj, como si fuesen los puntos cardinales. Coloca los restantes, o sea tres en ese sentido.
¿Cuántos pares hay? Tres pares.
¿Cuántos electrones quedan listos para formar enlace con los átomos del mismo o de otro elemento? Uno.
Realiza la siguiente actividad elabora las estructuras de Lewis de los siguientes elementos. Los elementos son el estaño, el flúor, el neón, el nitrógeno, el aluminio, el calcio.
Indica cuántos electrones de valencia están disponibles para formar enlaces químicos. Comparte la actividad con tus profesores y compañeros.
Te sugerimos que observes cómo se representa el enlace químico con la estructura de Lewis, en una molécula de agua, considerando los electrones de valencia.
En el transcurso de la sesión se ha mencionado mucho a Lewis, pero, ¿quién es él? ¿Por qué lo has tomado en cuenta?
La estructura de Lewis fue propuesta en 1916 por Gilbert Newton Lewis. En esta estructura se representan los electrones de valencia en forma de puntos, círculos pequeños o cruces alrededor del símbolo químico. Durante un cambio químico, el núcleo atómico y los electrones internos permanecen inalterados.
Los electrones de valencia son los que participan en los cambios químicos y pueden perderse, ganarse o compartirse.
Analiza las siguientes estructuras de Lewis.
El hidrógeno tiene un electrón de valencia, el berilio tiene dos, el boro tiene 3, el carbono posee 4, el nitrógeno tiene 5, el oxígeno posee 6, el flúor contiene 7 y el neón está completo porque tiene 8 electrones de valencia, lo que indica que este elemento es estable.
Es decir, no necesita formar un enlace químico para ganar, ceder o compartir electrones de valencia. Eso se sabe gracias a la cantidad de electrones que tienen en la órbita más alejada del núcleo.
Los electrones de valencia que tienen pareja ya no pueden formar otro enlace químico, entonces, ¿cuántos electrones están listos para formar enlaces?
Los elementos químicos que se unen para formar una molécula de agua son dos: el hidrógeno y el oxígeno, por lo tanto, necesitas conocer sus símbolos químicos y electrones de valencia.
La fórmula química del agua es H2O, lo que te indica que necesitas 2 átomos de hidrógeno y uno de oxígeno.
Primero coloca por separado los símbolos químicos de los dos átomos de hidrógeno, dibujando a un lado el único electrón de valencia que tienen. Para que el hidrógeno sea estable es necesario otro electrón de valencia.
Continua, necesitas hacer el paso anterior pero ahora con el átomo del oxígeno, queda así: 6 electrones de valencia alrededor del símbolo químico.
En esta ocasión ocuparas estos modelos corpusculares y palillos para representarlos.
Utiliza tu libreta y si tienes a la mano la plastilina ecológica que realizaste en sesiones anteriores la puedes utilizar.
Para que el oxígeno complete su órbita, le faltan 2 electrones de valencia, lo que le confiere mayor estabilidad.
Como podrás notar, los átomos de los elementos necesitan ser estables.
En el caso del hidrógeno se necesitan dos electrones de valencia y en el caso del oxígeno se necesitan 8 para que complete su órbita; de esta manera, cada átomo de hidrógeno comparte su electrón de valencia con uno del oxígeno, para formar un par electrónico, es decir, un enlace.
En otras palabras, el enlace químico se forma cuando cada átomo de hidrógeno y de oxígeno aporta un electrón de valencia para que compartan un par de electrones y se forme la molécula de agua.
Así es como queda representado el enlace químico de la molécula del agua mediante los electrones de valencia, a partir de la famosa estructura de Lewis que lleva usándose desde 1916, o sea, desde hace 104 años.
Pero, ¿por qué los químicos usan la estructura de Lewis? Para que comprendas cómo se encuentra unida la materia de todo lo que te rodea, así como la estructura de las sustancias químicas.
¿Se puede hacer uso de otra forma para representar el enlace químico?
Mediante el modelo atómico de Bohr, en este modelo se representan los electrones internos de los átomos, los cuales son los que se ubican más cercanos al núcleo del átomo.
Observa el ejemplo:

En este caso el sodio pierde un electrón para formar el catión Na+, y, por otra parte, el cloro gana un electrón para formar el anión cloruro, Cl-.
Hay una fuerte atracción electrostática entre ellos, por la diferencia de cargas.
Dos átomos de elementos iguales o diferentes pueden compartir dos o más pares de electrones, observa el ejemplo, la formación de la molécula de amoníaco NH3.
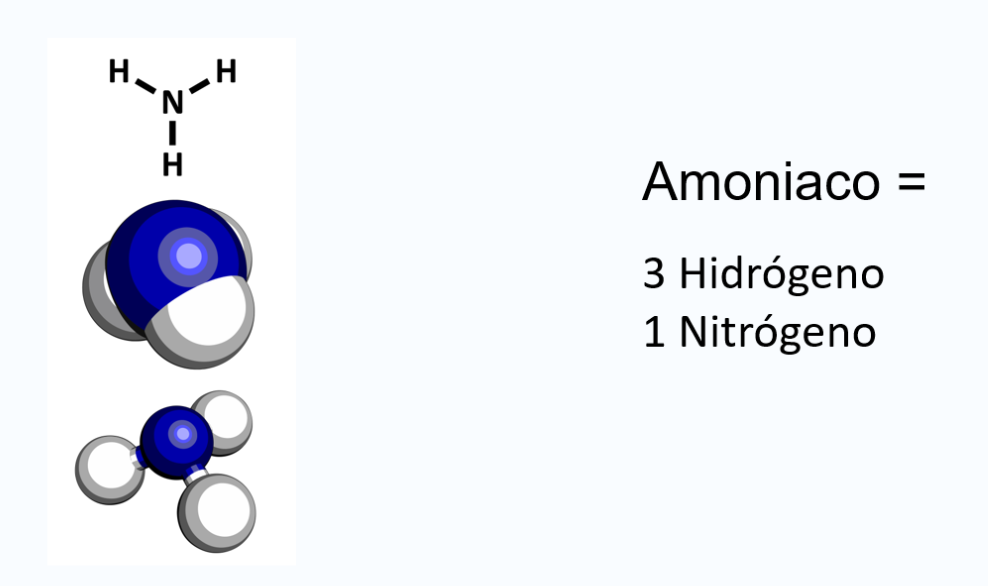
El átomo de nitrógeno forma un enlace con cada átomo de hidrógeno, mediante los electrones de valencia, de esta manera completa los 8 electrones de valencia que le dan la configuración del gas noble más cercano que es el neón. Por su parte, los 3 hidrógenos adquieren la configuración del gas noble más cercano que es el helio.
Como te puedes dar cuenta, representa el enlace químico con la estructura de Lewis, a partir de la formación de compuestos como el agua y el amoniaco para ejemplificar la compartición de electrones.
También representaste la transferencia de electrones, tomando como ejemplo la formación del compuesto de cloruro de sodio, este enlace se produce por la diferencia de cargas.
La aplicación de los enlaces químicos es para conocer la estructura y propiedades de diferentes compuestos químicos y aprovecharlos al máximo.
Por ejemplo, los semiconductores son materiales que han hecho posible el desarrollo actual de la electrónica y la informática.
Entre ellos se encuentra el silicio, un semimetal que en condiciones habituales son poco conductores de la corriente eléctrica, sin embargo, sus propiedades cambian notablemente cuando aumenta la temperatura y al introducir pequeñas cantidades de impurezas, como el boro, el fósforo, en consecuencia, se transforma en un semiconductor.
Otra aplicación es la elaboración de jabones.
Las manchas son simplemente sustancias que se han quedado pegadas en un lugar que no quieres, como las manchas de grasa, éstas y el agua no se mezclan muy bien, por lo que necesitas una sustancia que la disuelva y la arrastre. Generalmente utilizas un jabón o detergente.
El jabón es una molécula con un extremo hidrófilo, que se une al agua, y una parte hidrófoba que se une a las grasas. De este modo, para desmanchar la ropa con grasa, el jabón se une a la grasa y la lleva al agua, dejando la ropa limpia.
Por siglos, mujeres y hombres de ciencia han investigado el Universo para entenderlo y explicarlo.
El reto de hoy:
En el camino rompieron reglas, cometieron errores, hicieron experimentos extraños y riñeron entre sí. De esto y más trata el libro Ciencia rebelde que podrás encontrar en la colección de los Libros del Rincón.
Te recuerdo que debes realizar las actividades que se te proponen; y si te es posible, hacerlas llegar a tus profesoras y profesores.
¡Buen trabajo!
Gracias por tu esfuerzo.
Para saber más:


Login to join the discussion