¿Cómo es el sistema de clasificación de los elementos químicos?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:12¿Cómo es el sistema de clasificación de los elementos químicos?
Aprendizaje esperado: identifica la información de la tabla periódica, analiza sus regularidades y su importancia en la organización de los elementos químicos.
Énfasis: reconocer la organización de los elementos químicos en grupos y periodos, así como su carácter metálico.
¿Qué vamos a aprender?
Lee la siguiente frase célebre: “Por el laberinto se pierden fácilmente los hechos conocidos si no se planifican.”. Dimitri Mendeléiev
Reconocerás la organización de los elementos químicos en grupos y periodos, así como su carácter metálico.
¿Qué hacemos?
La tabla periódica es una herramienta irremplazable en la enseñanza de la Ciencia. Química.
Para comprender cómo es el sistema de clasificación de los elementos químicos, retomarás las aportaciones de Mendeléiev y Moseley, el modelo atómico de Bohr y la estructura de Lewis.
En la construcción de los modelos atómicos de los primeros dieciocho elementos químicos, te basarás en su estructura a partir del modelo atómico de Bohr.
Para comprender los criterios de clasificación de los elementos químicos, tomarás en cuenta el número atómico, los electrones de valencia y el número de órbitas o niveles energéticos.
Con ellos analizarás la organización de la tabla periódica en grupos y periodos.
Finalmente, de acuerdo con la posición que ocupen los elementos químicos en la tabla periódica, identificarás la tendencia de su carácter metálico.
Es de suma importancia que registres y respondas las preguntas, también que lleves a cabo las actividades que se plantean durante la sesión, para que los conocimientos y las habilidades desarrolladas las apliques en la construcción de modelos atómicos tridimensionales de los elementos químicos.
¿Sabías que en 1844 Charles Goodyear patentó un proceso conocido como vulcanización en el que el elemento clave del proceso fue el azufre?
Los materiales que utilizarás son los siguientes:
- Cuaderno de Ciencias. Química
- Libro de texto
- Regla
- Bolígrafo
- Colores
- Tabla periódica de los elementos químicos
Para la construcción de los modelos necesitarás: - Alambrón
- Un paquete de malvaviscos chicos de colores
- Hilo elástico transparente
- Pinzas
- Tres latas con una diferencia de dos centímetros de diámetro
Los materiales se revolvieron y tendrás que clasificarlos.
¿Qué criterios de clasificación utilizarías para ordenar los útiles escolares y el material para la práctica? Los clasificarás primero de acuerdo con su uso durante la sesión.
En el costado derecho colocarás los útiles escolares que se utilizan invariablemente en cada sesión. Y en el costado contrario, los materiales que varían de acuerdo con el tema de cada sesión.
Otro criterio sería clasificarlos de acuerdo con el material de que están hechos, en metales, plásticos y de madera.
¿Qué otros criterios de clasificación utilizaste?
El mejor criterio de clasificación, en este caso, depende del orden en el uso que les vas a dar. Pero éste no será siempre el mejor, sino que dependerá de la situación u objetivo que se pretenda alcanzar. ¿Cuáles serán los criterios que se consideran para clasificar los objetos de una tienda departamental o los libros en una biblioteca? Comenta con algún familiar tu respuesta, compleméntala y registra en la libreta.
Seguramente te has preguntado qué relación existe entre la actividad que se ha planteado y el sistema de clasificación de los elementos químicos.
Alguna vez te has cuestionado:
- ¿Qué es la tabla periódica de los elementos químicos?
- ¿Cómo están organizados los elementos químicos?
- ¿A qué se le llama periodo en la tabla periódica?
- ¿A qué se le llama grupo en la tabla periódica?
- ¿Qué es el carácter metálico de los elementos químicos?
- ¿Qué caracteriza a los elementos metálicos?
- Si construyes modelos atómicos tridimensionales, ¿qué se debe considerar?
¡Si la tabla quieres conocer... a organizarla debes aprender!
En sesiones anteriores identificaste las propiedades de los materiales y los elementos, la organización y la clasificación con las aportaciones de Cannizzaro y de Mendeléiev.
Ahora conocerás la información contenida en la tabla periódica actual de los elementos químicos.
Analiza el primer planteamiento: ¿Qué es la tabla periódica?
Es el sistema de clasificación de los elementos químicos de acuerdo al número atómico, en periodos y grupos.
¿Qué se entiende por sistema de clasificación?
Es el agrupamiento de los elementos de acuerdo con sus propiedades o atributos comunes entre ellos.
¿Cómo están organizados los elementos químicos en la tabla periódica?
En orden ascendente del número atómico, de izquierda a derecha. Inicia con el hidrógeno en la parte superior.
Observa la tabla periódica. ¿Cuántas filas tiene?
Son 7 filas horizontales, llamados periodos, hasta completar los 118 elementos químicos conocidos.
¿Cuántas columnas tiene?
Los elementos químicos están acomodados en 18 columnas verticales llamadas grupos. Este sistema de clasificación ordenó los elementos químicos con base en sus propiedades físicas y químicas; cabe señalar que ha tenido pocas variaciones en casi 150 años de haber sido propuesta.
¿A qué se le llama periodo en la tabla periódica?
Observa la tabla periódica. A los renglones horizontales de la tabla periódica se les denomina periodos y se numeran del 1 al 7.
En un mismo periodo se va incrementando uno a uno el número de protones, de acuerdo con su número atómico.
El número de periodo está relacionado con el número de órbitas en las que están distribuidos los electrones en los átomos de los elementos químicos.
El número máximo de electrones de valencia en cada órbita son: 2 en la primera, 8 en la segunda y 18 en la tercera.
Para profundizar realiza la siguiente actividad práctica:
Iniciarás con la construcción del modelo atómico del primer elemento de la tabla periódica, el hidrógeno, H, ¿cuál es su número atómico? Su número atómico es uno.
Por lo tanto, de acuerdo con el modelo atómico de Bohr, tiene un protón y un electrón que lo hacen eléctricamente neutro. Constrúyelo.
Auxiliándose del hilo elástico, unirás un malvavisco al centro del aro para simular su núcleo e introducirás en el aro un malvavisco para representar al electrón en su única órbita.
Repetirás el mismo procedimiento para la construcción del átomo del elemento helio.
Identifica en la tabla periódica el número atómico del elemento helio, es dos.
Ahora colocarás nuevamente un bombón al centro para representar el núcleo e introducirás dos electrones en la primera órbita.
Observa con detenimiento ambos modelos y registra en tu libreta qué tienen en común el hidrógeno y el helio.
Ambos tienen sus electrones distribuidos solamente en una órbita.
Esta es la razón por la cual se encuentran ubicados en el periodo número uno de la tabla periódica.
El helio es un elemento en estado gaseoso estable al tener completa su única órbita con el número máximo de electrones, que son dos.
¿A qué se le llama grupo en la tabla periódica? Observa nuevamente tu tabla periódica.
Los grupos se numeran de izquierda a derecha y son 18 grupos.
En esta sesión te centrarás en los elementos químicos representativos, es decir, en los grupos 1, 2, 13, 14, 15, 16, 17 y 18 de la tabla periódica.
Recuerda que, de acuerdo con la estructura de Lewis, los electrones de valencia que tienen los átomos de los elementos de cada grupo son:
- Para el grupo uno, un electrón de valencia.
- Para el grupo dos, dos electrones de valencia.
- Para el grupo trece, tres electrones de valencia.
- Para el grupo catorce, cuatro electrones de valencia.
- Cinco electrones de valencia para el grupo quince.
- Seis electrones de valencia para el grupo dieciséis.
- Siete para el grupo diecisiete.
- Y ocho para el grupo dieciocho.
Una manera de identificar fácilmente los electrones de valencia en cada grupo es considerar el número con el que termina, por ejemplo, el grupo 13 tiene 3 electrones de valencia; el grupo 14, 4 electrones de valencia, y así sucesivamente.
Ahora construye el modelo atómico del litio, Li. Éste tiene el número atómico 3 en la tabla periódica, ¿podrías deducir cuántos protones tiene? Y, por lo tanto, ¿cuántos electrones? Tres.
Distribuye los electrones en las órbitas. ¿Cuántos electrones introducirás en la primera órbita? 2 electrones, te sobra uno, ¿dónde lo vas a colocar? En la segunda órbita.
Arma el elemento sodio tiene 11 electrones, 2 se van a colocar en la primera órbita, 8 en la segunda y 1 en la tercera órbita.
Observa los modelos del hidrógeno, litio y sodio.
¿Qué tienen en común? Todos ellos tienen un electrón de valencia en su última órbita.
Por lo tanto, se ubican en el grupo uno de la tabla periódica.
Ahora, si analizas por el número de órbitas, tienes lo siguiente: el hidrógeno, por tener una órbita, se encuentra en el periodo uno.
El litio, por tener dos órbitas, se localiza en el periodo dos.
Entonces, el sodio, por tener tres órbitas, ¿dónde se ubicará? En el periodo tres.
¿Por qué los globos que contienen helio, He, se elevan? El helio es un gas menos denso que el aire. Por su baja densidad está constantemente escapando de la atmósfera terrestre. Se calcula que en 300 años este gas ya no estará presente en la Tierra.
Un globo con helio puede recorrer hasta 3 000 km, lo que ocasiona que caiga en lagos, ríos o mares.
Construye los modelos atómicos de los primeros dieciocho elementos químicos de la tabla periódica.
Juega a... ¡el Elemento Submarino!
Aplicarás los criterios del sistema de clasificación de la tabla periódica y las reglas en el juego.
Aprovechando tus conocimientos de Matemáticas en el uso de localizar puntos en el plano cartesiano, harás lo mismo tomando en cuenta que en el eje vertical localizarás los 18 grupos y en el eje horizontal, los 7 periodos.
Ubica al hidrógeno-submarino en la tabla periódica. ¿Y qué ocupa la posición uno?
En el mundo de la química es más importante el saber por qué, que reducir el aprendizaje a la memorización.
Teniendo presente que el hidrógeno-submarino, por tener una órbita, se encuentra ubicado en el periodo uno y, por tener un solo electrón, éste se ubicará en el grupo uno.
Lo colocarás en el espacio que le corresponde. Harás lo mismo para los elementos helio, litio y sodio. Para el caso del helio-submarino, lo ubicas en el periodo uno y en el grupo 18 por ser un elemento estable con su única órbita completa con dos electrones.
El litio se ubica en el segundo periodo por sus dos órbitas, y en el grupo uno, por tener sólo un electrón de valencia.
Un dato curioso es que el elemento litio se utiliza en la fabricación de fármacos antidepresivos.
Tomando en cuenta el modelo atómico del sodio, ¿qué consideras para su ubicación en la tabla periódica? Sus órbitas y su electrón de valencia, entonces lo ubicarás en el periodo tres y en el grupo uno.
Un dato curioso del sodio en la vida cotidiana es que se utiliza en la producción de desodorantes.
Revisa el caso del berilio y otros elementos a través de las siguientes preguntas, no es necesario que las registres en tu libreta. Utilízalas como guía para el análisis en la construcción de los modelos atómicos y su ubicación en la tabla periódica de los elementos.
- ¿Cuántas órbitas tiene?
- ¿Cuántos electrones de valencia tiene?
- ¿Ubicas la intersección de estos valores? Coloca la etiqueta del elemento en esta intersección.
Analiza el modelo atómico del boro.
- ¿Cuántas órbitas tiene?
- ¿Cuántos electrones de valencia?
- ¿Ubicas la intersección de estos valores? Coloca la etiqueta del elemento en esta intersección.
El átomo de carbono.
- ¿Cuántas órbitas tiene?
- ¿Cuántos electrones de valencia tiene?
- ¿Ubicas la intersección de estos valores? Coloca la etiqueta del elemento en esta intersección.
El nitrógeno - ¿Cuántas órbitas tiene?
- ¿Cuántos electrones de valencia?
- ¿Ubicas la intersección de estos valores? Coloca la etiqueta del elemento en esta intersección.
El oxígeno - ¿Cuántas órbitas tiene?
- ¿Cuántos electrones de valencia?
- ¿Ubicas la intersección de estos valores? Coloca la etiqueta del elemento en esta intersección.
Flúor - ¿Cuántas órbitas tiene?
- ¿Cuántos electrones de valencia?
- ¿Ubicas la intersección de estos valores? Coloca la etiqueta del elemento en esta intersección.
Neón - ¿Cuántas órbitas tiene?
- ¿Cuántos electrones de valencia tiene?
- ¿Ubicas la intersección de estos valores? Coloca la etiqueta del elemento en esta intersección.
Magnesio - ¿Cuántas órbitas tiene?
- ¿Cuántos electrones de valencia tiene?
- ¿Ubicas la intersección de estos valores? Coloca la etiqueta del elemento en esta intersección.
Aluminio - ¿Cuántas órbitas tiene?
- ¿Cuántos electrones de valencia?
- ¿Ubicas la intersección de estos valores? Coloca la etiqueta del elemento en esta intersección.
Silicio - ¿Cuántas órbitas tiene?
- ¿Cuántos electrones de valencia tiene?
- ¿Ubicas la intersección de estos valores? Coloca la etiqueta del elemento en esta intersección.
Pon a prueba tus conocimientos de manera divertida e interactiva, apoyándote en los siguientes modelos y en el registro de la actividad en tu libreta.
Inténtalo con algún familiar, checa tu tiempo para saber qué tan rápido eres para ubicar los siguientes cuatro elementos:
Responde en tu libreta.
Fósforo - ¿Cuántas órbitas tiene?
- ¿Cuántos electrones de valencia?
- ¿Ubicas la intersección de estos valores? Coloca la etiqueta del elemento en esta intersección.
Azufre - ¿Cuántas órbitas tiene?
- ¿Cuántos electrones de valencia tiene?
- ¿Ubicas la intersección de estos valores? Coloca la etiqueta del elemento en esta intersección.
Cloro - ¿Cuántas órbitas tiene?
- ¿Cuántos electrones de valencia?
- ¿Ubicas la intersección de estos valores? Coloca la etiqueta del elemento en esta intersección.
Argón - ¿Cuántas órbitas tiene?
- ¿Cuántos electrones de valencia?
- ¿Ubicas la intersección de estos valores? Coloca la etiqueta del elemento en esta intersección.
Ahora realiza la siguiente actividad: investiga e ilustra la aplicación y uso en la vida cotidiana de cada elemento de la actividad uno. - ¿Qué es el carácter metálico?
- ¿Qué caracteriza a los elementos metálicos?
Una de las propiedades más importantes que encuentras al consultar la tabla periódica es el carácter metálico. Éste se refiere a la tendencia de los elementos químicos para alcanzar la estructura del gas noble más cercano. A un elemento químico se le considera metal cuando tiende a perder electrones de valencia y forma cationes.
Los metales ocupan más de tres cuartas partes de los elementos en la tabla periódica. Algunas de sus propiedades físicas: tienen un brillo característico, son dúctiles y maleables, buenos conductores del calor y la electricidad. Sus puntos de fusión y ebullición son altos. Tienen alta densidad. La mayoría son duros: no se rayan con facilidad. Son tenaces: resisten los golpes y las altas presiones. Son sólidos a temperatura ambiente, excepto el mercurio, el galio, el cesio.
En cambio, al elemento químico que tiende a ganar electrones, para alcanzar la estructura más estable del gas noble más cercano, se le conoce como no metal y tiende a formar aniones.
Algunas propiedades físicas de los no metales es que son opacos, excepto el yodo, que es brilloso; frágiles, excepto el carbono en su forma de diamante; malos conductores del calor y la corriente eléctrica, excepto el carbono en forma de grafito. No son dúctiles ni maleables. En general, tienen baja densidad. Los hay sólidos, líquidos y gases.
Los metaloides, por estar en el límite entre los metales y los no metales, presentan propiedades semejantes a ambos, según el elemento con el cual forman un enlace químico.
¿En qué dirección aumenta el carácter metálico de los elementos químicos en la tabla periódica?
El carácter metálico aumenta al moverte de derecha a izquierda y de arriba hacia abajo en la tabla periódica.
Observa la siguiente imagen:
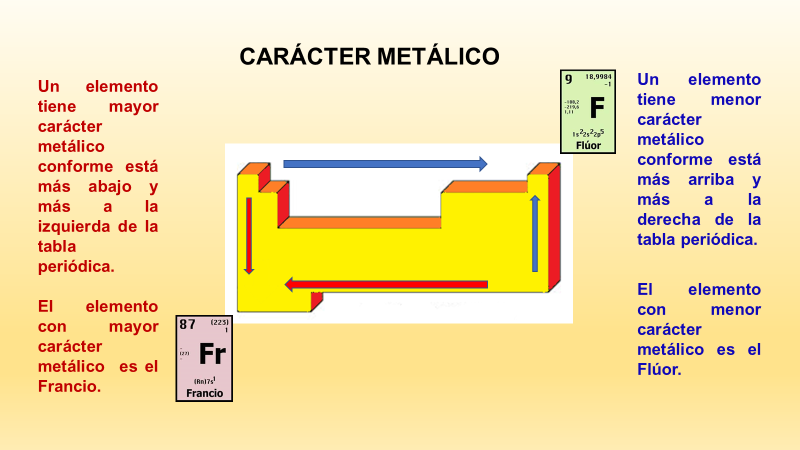
Al realizar este ejercicio, puedes observar que el elemento más metálico es el francio.
Ahora, si te mueves en el sentido contrario, encontrarás que el elemento menos metálico es el flúor.
El hidrógeno es la excepción, ya que se localiza en el extremo izquierdo de la tabla debido a su estructura atómica; no obstante, comparte propiedades químicas con el grupo de los halógenos, por lo que es considerado un no metal.
Aunque la mayoría de los elementos conocidos son metálicos, la abundancia de cada uno de ellos en la Tierra como en otras regiones del Universo, es pequeña comparada con la de elementos no metálicos como el hidrógeno, el helio y el oxígeno.
Cerca de 91% de todos los átomos del Universo son de hidrógeno, 8.75% son átomos de helio y sólo 0.25% restante son átomos de otros elementos.
Además de haber construido sus modelos atómicos, lograste ubicarlos en la tabla periódica.
Debes reconocer que los elementos químicos están ordenados en la tabla periódica en orden creciente de su número atómico.
Recuerda que el grupo al cual pertenecen los elementos químicos está relacionado con el número de electrones de valencia, y que el número de periodo corresponde al número de órbitas que tienen los átomos de los elementos químicos.
Así como también tener presente que los elementos metálicos tienen la tendencia de ceder electrones de valencia y formar cationes. Los elementos que pertenecen a los no metales tienden a aceptar electrones y formar aniones. La importancia de conocer las propiedades de los elementos químicos en la vida cotidiana se debe a que éstos contribuyen al desarrollo del cuerpo humano. Sabes que el elemento azufre, un no metal de color amarillo capaz de fundirse y cambiar al color naranja rojizo, no podría ser ingerido de esta forma.
Sin embargo, sí puede ser ingerido en alimentos que lo contienen, como el ajo y el pescado; contribuye a formar proteínas en el organismo.
El reto de hoy:
Se te recomienda que en un momento de esparcimiento leas el libro titulado Los caballeros de la tabla periódica: Aventuras elementales, del autor Luis Javier Plata.
Acompaña a los caballeros a conocer el porqué de todas las cosas. También se te recomienda el libro En búsqueda de los elementos, de Isaac Asimov.
¡Buen trabajo!
Gracias por tu esfuerzo.
Para saber más:


Login to join the discussion