¿Cómo identifico los elementos químicos?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:12¿Cómo identifico los elementos químicos?
Aprendizaje esperado: identifica que los átomos de los diferentes elementos se caracterizan por el número de protones que los forman.
Énfasis: reconocer que la identidad de los elementos químicos se debe al número de protones en su núcleo y explicar la diferencia con la masa atómica. Asimismo, identificar que los elementos tienen un espectro electromagnético característico.
¿Qué vamos a aprender?
“Las ideas científicas iluminan los rincones oscuros”. Jill Tarter, Astrónoma
Reconocerás que la identidad de los elementos químicos se debe al número de protones en su núcleo y explicarás la diferencia con la masa atómica, asimismo, identificarás que los elementos tienen un espectro electromagnético característico.
Sabías que: los fuegos artificiales con los que celebras muchas festividades son parte de un hermoso espectáculo de química.
La pirotecnia utiliza pólvora y compuestos químicos para producir, mediante explosiones controladas, un espectáculo de flamas de colores y chispas brillantes.
Esta sesión se centrará en este bello espectáculo y se fundamentará a través de esta colorida ciencia: la química.
Necesitarás tu cuaderno de Ciencias. Química que, como lo habrás notado, se ha convertido en una bitácora científica, ya que te ha permitido documentar, de forma precisa, los diversos experimentos que has realizado, así como tus resultados y todas las notas importantes. Es indispensable tener el libro de texto de Ciencias. Química, el cual es una valiosa herramienta para fortalecer los contenidos.
También necesitarás la tabla periódica, que la puedes buscar en tu libro de texto, además de colores, bolígrafos y lápiz.
¿Qué hacemos?
Puedes notar que la pirotecnia, además de iluminar el cielo de colores, involucra fenómenos químicos que tienen que ver con los elementos de la tabla periódica.
Pero ¿cómo es esto posible? Recuerda que todos los átomos de los elementos químicos tienen una estructura común. Lo puedes apreciar en este modelo atómico, que es una forma de representar los átomos y te permite entenderlo.
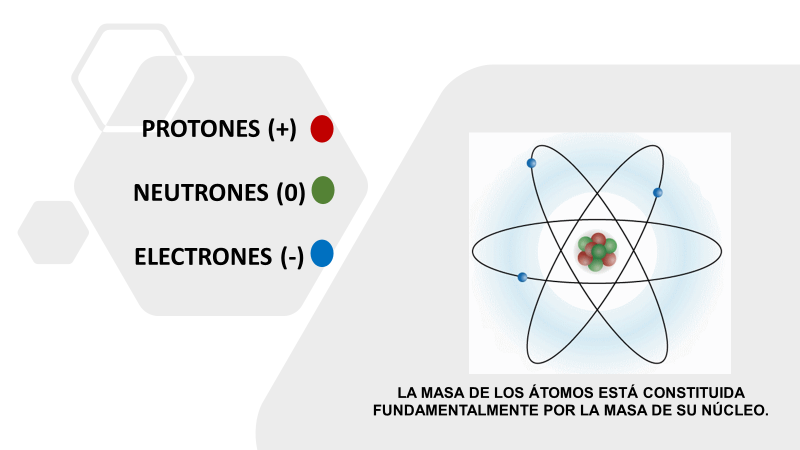
Ten en cuenta esta pregunta que deberás responder al final de la sesión: ¿Qué elemento representa tu modelo atómico?
Observa que los átomos de los elementos químicos tienen un núcleo formado por protones con carga positiva y los neutrones sin carga eléctrica.
Los electrones con carga negativa se mueven alrededor del núcleo. Entonces, ¿qué carga eléctrica tienen los átomos de un elemento dado?
Es una carga total neutra debido a que hay la misma cantidad de protones que de electrones.
La masa de los neutrones es ligeramente superior a la masa de los protones y alrededor de dos mil veces mayor que la masa de los electrones. Dicho de otra manera, la masa de los átomos está constituida fundamentalmente por la masa de su núcleo, es decir, por la masa de protones y de neutrones.
¿Cómo identifico los átomos de un elemento químico?
Para que te quede más claro, puedes decir que el número de protones es como una huella digital de los átomos, es única e irrepetible; si cambia el número de protones, cambia el elemento del que hablas.
Ejemplo: el hidrógeno tiene un protón y el helio tiene dos protones en su núcleo.
¿Recuerdas cuál es el símbolo químico de cada uno de ellos? H para el hidrógeno y H mayúscula con una e minúscula para el helio.
¿Cuál es la manera con la cual se representa a los protones, neutrones y electrones?
Anota en tu bitácora científica: las partículas subatómicas que constituyen al átomo, su símbolo, la carga eléctrica y en qué región del átomo las puedes encontrar.
El número de protones en el núcleo de los átomos es el que determina el número atómico de cada elemento químico en orden creciente en la tabla periódica.
Asimismo, la ubicación de los elementos en la tabla periódica depende de las propiedades de cada uno.
El número de protones es igual al número de electrones que tienen los átomos de un elemento químico cuando son eléctricamente neutros.

El boro, por ejemplo, tiene 5 protones en su núcleo; por lo tanto, su número atómico es 5, ocupando el lugar 5 en la tabla periódica, por lo tanto, tiene 5 electrones distribuidos en sus órbitas.
Dato curioso: El cuerpo humano recambia prácticamente todos los átomos que lo forman en un plazo de 5 años, ¡unos 1027 átomos.
El protón contribuye a atraer a los electrones y mantenerlos orbitando alrededor del núcleo. Esa propiedad se debe a la diferencia de cargas, pues los protones tienen carga positiva que atrae a los electrones con carga negativa. Ahora ya sabes quién mantiene a los electrones en su lugar.
Es interesante saber cómo se comportan los electrones y todo gracias a los protones
¿Sabes qué elemento químico representa tu modelo atómico?
Observa qué datos puedes obtener del él. Completa la siguiente tabla.

Cuentas con tu modelo atómico y tienes órbitas, en ellas, los electrones se encuentran distribuidos de la siguiente manera: en la primera órbita 2, electrones; en la segunda órbita, 8 electrones, y en la tercera órbita, 1 electrón. Sumados, dan 11 electrones.
¿Qué elemento será?
Recuerda que la cantidad de protones y electrones es igual en un átomo eléctricamente neutro, por lo tanto, el elemento tiene 11 protones igual a 11 electrones. También representa el número atómico, en orden creciente en la tabla periódica.
Busca en tu tabla periódica qué elemento ocupa el lugar 11. ¿qué elemento es?
Es el sodio Na.

Notaste aún hacen falta datos en la tabla. La masa atómica se representa con la letra A, ¿qué es?
Las masas de los átomos son relativas, esto quiere decir que se toma como unidad la masa del elemento con menor magnitud.
Observa con atención tu tabla periódica, ¿cuál es el elemento que tiene la menor magnitud de masa? Es el hidrógeno.
Actualmente se toma como unidad la doceava parte del átomo de carbono con una masa atómica de 12 u.
Las masas atómicas se calculan con el promedio de las masas de los distintos isótopos de cada elemento, según la abundancia relativa de cada uno de ellos, es decir, el porcentaje en que cada isótopo de un elemento se encuentra en la naturaleza.
A esto se debe que el valor de las masas atómicas de los elementos se expresa con número entero y decimal, por ejemplo, el magnesio, con una magnitud de masa atómica de 24.31 u.
Anota la magnitud de la masa atómica del sodio, Na. En la tabla periódica se expresa con número entero y decimal, como se había mencionado; para fines prácticos, se redondea.
En química, el número másico o número de masa es la suma del número de protones y el número de neutrones del núcleo de un átomo de un elemento en particular, por lo que este valor se expresa con un número entero.
Si para el caso del sodio el número de masa es 23 y el número atómico, representado con la letra (Z), es 11, ¿cuántos neutrones tienen los átomos de sodio? Tiene 12 neutrones.
Explica a un familiar cómo obtuviste el resultado. Por lo tanto, ya conoces qué es el número atómico y la masa atómica; estas magnitudes definen a un elemento.
Realiza la siguiente actividad:
Descubre bajo estas pistas de qué elemento se está hablando.
Pista número 1:
Este es un elemento que lo puedes encontrar en el jugo gástrico, y juega un papel importante en la digestión. Le puedes agradecer a este elemento que las proteínas y las grasas que provienen de los alimentos se transforman en unidades más pequeñas y seguir su camino en el intestino.
Otro rastro que tiene este elemento es que, en grandes dosis, es un elemento tóxico. Por eso se usó como arma química en la Primera Guerra Mundial, como componente del gas mostaza.
Pero el organismo necesita pequeñas dosis para funcionar correctamente.
Coloca en una esfera que simularás, el núcleo atómico a 17 esferas con un símbolo de p+, que representa a los protones.
Otra pista: también cuando se une al sodio deja de ser tóxico y forma la sal común. De esta forma participa en el equilibrio del agua del organismo y en el mantenimiento de la presión arterial.
Otra pista es: coloca a tu esfera, a tu simulador de núcleo, 18 esferas con un símbolo n°, que representa a los neutrones.
¿Son suficientes pistas para descubrir este elemento?
Antes de responder, descubre quién es el siguiente elemento.
La pista número 1 es: este elemento es muy abundante, ya que en 75% del Universo lo vas a poder encontrar, pero seguramente, combinado con otros elementos como con el oxígeno y el carbono.
Algo sorprendente de este elemento: puede ser utilizado como combustible para el transporte y para generar electricidad mediante baterías de combustible. Su estado de agregación preferido es gaseoso, es incoloro e inodoro, no es tóxico, pero es altamente flamable.
En esta esfera colocarás solamente una esfera de protones.
La siguiente pista es que sólo tiene un electrón en su única órbita. Este elemento tiene tres isótopos.
El ligero, que es el más abundante, es un protón y cero neutrones. El otro isótopo, llamado deuterio, cuyo núcleo alberga un protón y un neutrón, y el último es el tritio, cuyo núcleo es un protón y dos neutrones.
¿Descubriste de qué elementos se trata?
La última pista: el primero es un químico que se utiliza frecuentemente para la purificación del agua y de desinfectantes. ¿Qué masa atómica tiene?
El elemento químico es: el cloro.
El otro elemento: éste se combina en dos proporciones a una con el oxígeno, por lo tanto, es el hidrógeno.
Estos aprendizajes te ayudan a comprender aquellos fenómenos que te rodean y que son tan cotidianos. Por ejemplo:
- ¿Qué es la fusión nuclear?
- ¿Cómo es que funciona el Sol?
El Sol convierte cada segundo unos 564 millones de toneladas de hidrógeno en 560 millones de toneladas de helio, lo que significa que unos 4 millones de toneladas de materia se transforman en energía solar, una pequeña parte de la cual llega a la Tierra y sostiene la vida.
La fusión nuclear es la transformación de dos átomos ligeros, se unen para formar otro núcleo más pesado, generalmente liberando partículas en el proceso. De este modo se transforman en helio, liberando una gran cantidad de energía en forma de radiación electromagnética que percibes como luz y calor.
Es momento de experimentar, si te es posible, con esto conocerás más acerca de las propiedades de los elementos químicos que los hacen luminosamente especiales.
¡ADVERTENCIA!
En este experimento se te mostrara cómo hacer fuego de colores de manera sencilla; sin embargo, como algunos materiales que se utilizan son altamente inflamables, siempre debes de tomar las precauciones necesarias para manipularlos. ¡no lo practiques solo!, solicita siempre la ayuda de tus padres o un adulto para evitar cualquier tipo de accidente.
Y, sobre todo, toma las medidas de prevención de accidentes, como utilizar una bata, y manipular las sustancias o instrumentos bajo las indicaciones que estén presentes en los instructivos o que te proporcionen tus profesoras y profesores.
Necesitarás:
- Un encendedor o cerillos
- Ácido bórico
- Acetona o quitaesmalte de uñas
- Un poco de alcohol
- Cuatro vidrios de reloj o recipientes de aluminio pequeños, también pueden ser recipientes de vidrio que resistan el calor
- Hilo de cobre
Paso número 1:
Lo que tienes que hacer es colocar un poco de hilo de cobre en uno de los recipientes, luego colocar un poco de acetona en el segundo recipiente, en el tercero colocarán un poco de ácido bórico y para el cuarto puedes colocar un poco de alcohol, unas gotitas de ácido bórico e hilo de cobre.
Paso número 2
Es importante que en esta etapa del experimento tomes precauciones limpiando la mesa de trabajo, pues no debe quedar ni un poco de restos de los materiales que usaste, asimismo, se sugiere lavarse las manos antes de tomar el encendedor.
Paso número 3
Procede a encender los recipientes uno por uno, con ayuda de tu encendedor o cerillos, luego de ello, observa cuidadosamente cada recipiente.
Registra tus resultados en una tabla que titules: Resultados obtenidos, y en la primera columna Sustancia y en la segunda Espectro electromagnético (color obtenido). Observa los colores de la iluminación de la flama durante la actividad experimental.
Como observaste, en el recipiente con ácido bórico la llama se tornó color verde intenso. El recipiente que tiene acetona se tornó de un color anaranjado. En el recipiente que colocaste hilo de cobre, se tornó de un color verde más tenue que el primero. Por último, el recipiente con la mezcla de los tres se tornó la flama azul. ¿A qué se deben esos colores?
El color es debido a la radiación electromagnética emitida en forma de luz; va a depender de la longitud de la onda, de manera que, al colocar el compuesto en la flama, toma una coloración específica. Es importante saber que cada compuesto químico cuenta con su propio patrón de ondas, por eso, cuando se enciende el recipiente, la temperatura se eleva y estas ondas se ven alteradas, por tanto, la llama toma un color determinado.
Entonces, ¿qué pasa en los fuegos artificiales? En el interior de la esfera de pólvora, que constituye un fuego artificial, se adicionan compuestos químicos metálicos que dan color a la detonación.
La combustión de la pólvora genera una explosión donde el calor alcanza 900º Celsius. A esta temperatura, los electrones de los átomos de los elementos metálicos se excitan y emiten luz de diferentes colores.
Ahora ya sabes que el número atómico de un elemento químico se debe a la cantidad de protones que tiene en su núcleo; en un átomo eléctricamente neutro, la cantidad de electrones es la misma. Los elementos se ordenan en la tabla periódica con base en su número atómico y sus propiedades.
Por medio de las actividades experimentales, observaste los hermosos colores que emitieron los átomos de los elementos, cabe señalar que son específicos para cada elemento, lo que se debe a la radiación electromagnética emitida en forma de luz. Los fuegos artificiales son pura química.
Su origen está relacionado con la invención de la pólvora hace más de 1 000 años en China.
En México hay varios municipios en los que la pirotecnia es una actividad económica fundamental, uno de ellos es Tultepec, en el Estado de México. En 1991, los artesanos pirotécnicos de este lugar recibieron el Premio Nacional de Ciencias y Artes en la categoría de artes y tradiciones populares.
El sodio es responsable de los colores amarillos y los dorados. El bario produce los verdes. El cobre (carbonato de cobre) da lugar al color azul. Las sales de estroncio dan color rojo. El titanio es responsable de los destellos blancos y plateados. El magnesio incrementa el brillo y la luminosidad. El antimonio da un efecto de los halos de los brillos: glitter.
Cuando los átomos de un elemento químico reciben energía, sus electrones se excitan, saltan de una órbita a otra con un nivel de energía mayor. Los átomos excitados son muy inestables, por ello, los electrones vuelven a su estado fundamental o basal, por lo que emiten energía en forma de luz.
Entonces, ¿cada elemento químico posee, como, una huella digital? Llámala huella química, lo más extraordinario es que, a diferencia de la huella dactilar, ésta es colorida. Y sirve también para identificar de qué elemento se trata.
Pero ¿cómo se identifica esta huella, bueno, este espectro luminoso? A través de un instrumento llamado espectrómetro atómico.
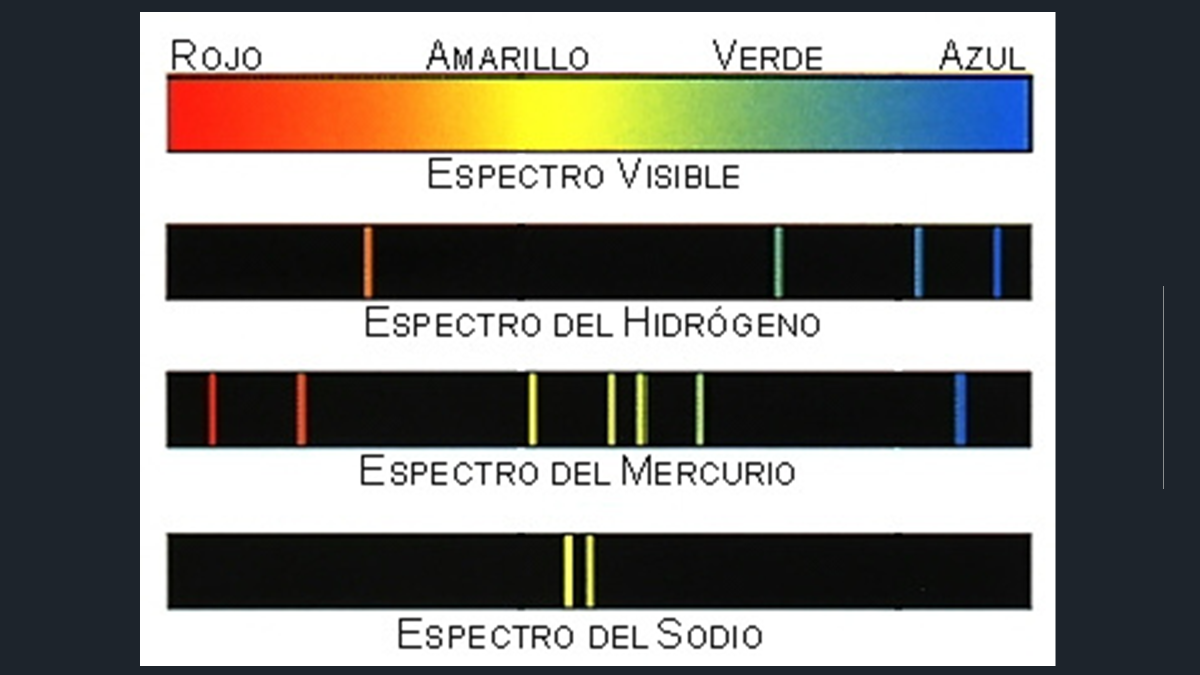
Cada elemento deja un rastro o pista única que lo diferencia de los demás elementos, por ejemplo, observa primero el espectro de luz visible que va desde el rojo hasta el azul. Observa el primer espectro del elemento hidrógeno, compáralo con el mercurio y del sodio. ¿Notaste lo diferentes son?
Observa los espectros de los demás elementos químicos.
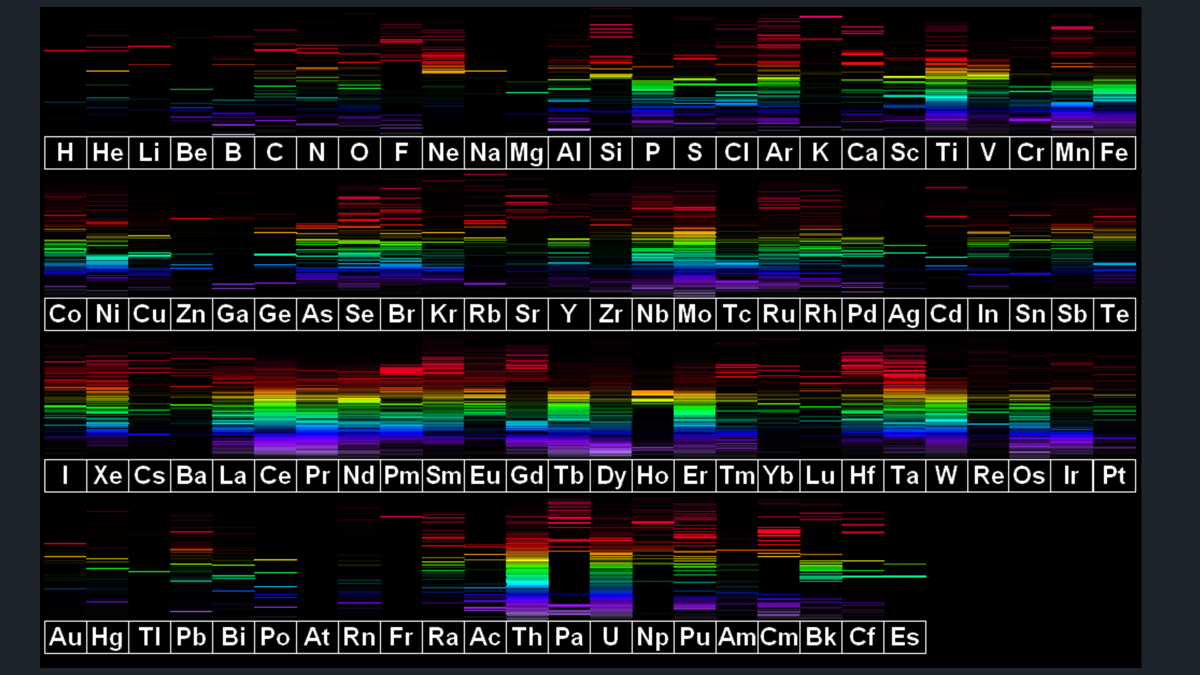
Cada uno tiene un espectro único.
El reto de hoy:
Recuerda que tu libro de texto es la herramienta que tienes a tu alcance para consultar el tema que has estudiado en esta sesión y para aclarar cualquier duda.
Si te interesa saber más sobre los átomos, sus partículas subatómicas y crear modelos, se te sugiere consultar el siguiente sitio en Internet:
http://www.objetos.unam.mx/quimica/fabricaAtomos/index.html
Recuerda que realizar las actividades que se te proponen, te pedimos, si es posible, hacerlas llegar a tu profesora y profesor.
Recuerda que puedes invitar a sus familiares a experimentar y conocer más sobre el fascinante mundo de la química.
¡Buen trabajo!
Gracias por tu esfuerzo.
Para saber más:


Login to join the discussion