¿Cuál es la importancia de los modelos en el conocimiento científico?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:12¿Cuál es la importancia de los modelos en el conocimiento científico?
Aprendizaje esperado: identifica los componentes del modelo atómico de Bohr (protones, neutrones y electrones), así como la función de los electrones de valencia para comprender la estructura de los materiales.
Énfasis: identificar los componentes del modelo atómico de Bohr y reconocer la función de los electrones de valencia para comprender la estructura de los materiales.
¿Qué vamos a aprender?
La ciencia sirve para predecir, controlar, clasificar y explicar los fenómenos de la naturaleza, por eso es importante conocer su historia y sus avances, muchos científicos han elaborado teorías, modelos y leyes, gracias a ellos puedes comprender lo que sucede a tu alrededor.
La ciencia influye en la sociedad en diversos temas como el transporte, la alimentación, los recursos energéticos, la conservación del medio ambiente, la salud, entre otros.
Identificarás los componentes del modelo atómico de Bohr, reconocerás la función de los electrones de valencia para comprender la estructura de los materiales.
¿Qué hacemos?
Para iniciar lee la siguiente frase de Niels Henrik David Bohr: “Lo opuesto de una formulación correcta es una formulación incorrecta. Pero lo opuesto de una verdad profunda puede ser muy bien otra verdad profunda”.
Los materiales que utilizarás son: cuaderno de notas, tu libro de texto de Ciencias con énfasis en química y bolígrafos, lápiz escuadras o regla y colores.
Escribe las dudas o dificultades que surjan al resolver los planteamientos. Éstas las puedes resolver al revisar tu libro de texto o al reflexionar en torno a los problemas que se discutirán.
Lo importante de conocer a la estructura más pequeña de la materia es, sin duda comprender que la base de la química está en el átomo. Un átomo al unirse con otros, forma moléculas como el ozono, compuestos como el agua o mezclas como el aire. Los modelos atómicos son representaciones gráficas que te permiten estudiar y entender cómo está formada la materia de manera más sencilla.
- ¿De qué están hechas las cosas, los seres vivos y todo lo que te rodea?
- ¿Cómo está conformado un átomo?
- ¿Qué modelos atómicos conoces?
A partir de las respuestas a las preguntas anteriores escribe un breve párrafo en el que expliques cómo está conformado el átomo. Te sugerimos que lo representes por medio de un dibujo y lo compartas con algún familiar.
El átomo es la estructura con la cual se organiza la materia en el Universo físico, contiene sub partículas llamadas, protones, neutrones y electrones; en un concepto simple el átomo es la partícula más pequeña de la materia compuesta por un núcleo que tiene cargas positivas llamadas protones, y neutras que se denominan neutrones y alrededor del núcleo se encuentran girando las partículas negativas conocidas como electrones. Observa la siguiente imagen:

Un físico danés publicó un modelo atómico el cuál describía que los electrones viajaban en órbitas, este modelo lo elaboró a partir del átomo de Hidrógeno. Se refiere al modelo atómico de Bohr.
Observa las siguientes imágenes y responde las siguientes preguntas:
En el modelo de Bohr:
- ¿Cuáles son los electrones internos?
- ¿Cuáles son los electrones externos?
- ¿Qué otros nombres reciben los electrones externos? y ¿qué función tienen?
- ¿Qué explica este modelo?
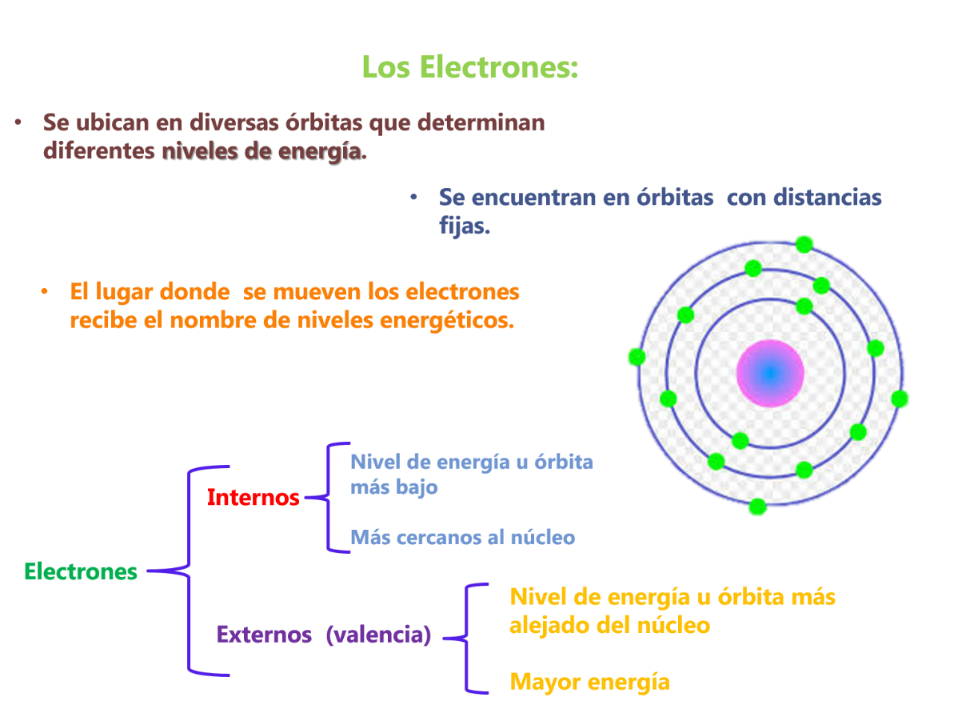
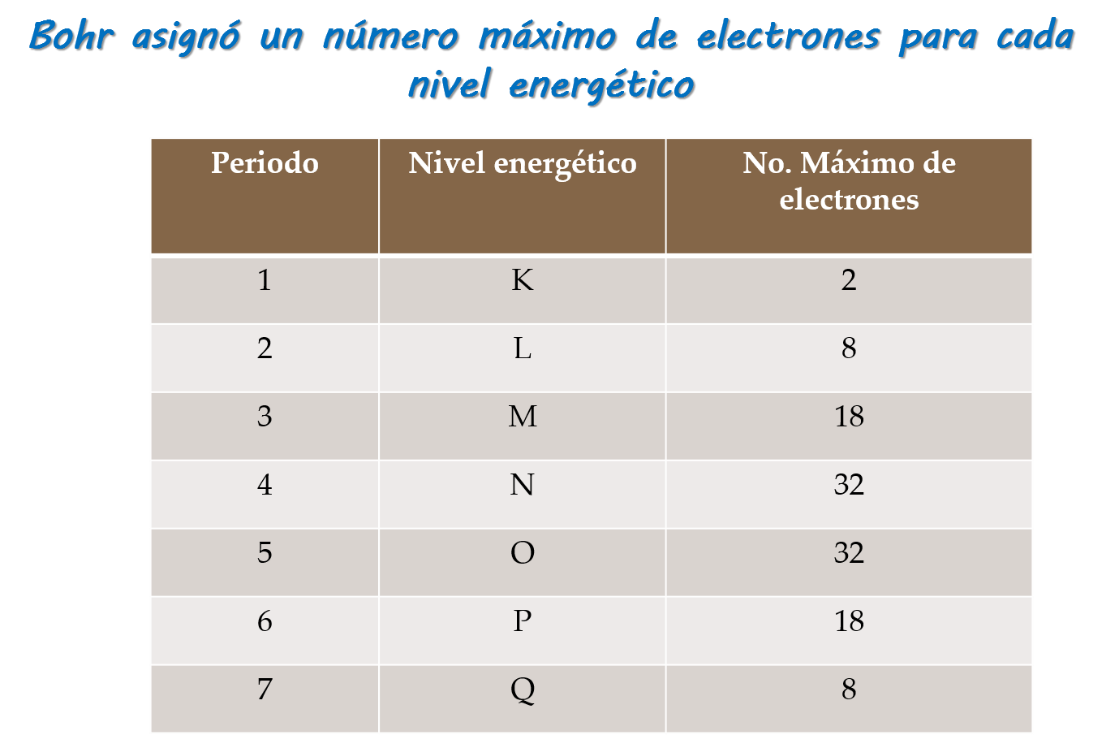

En la actualidad este modelo se utiliza para explicar:
- La estabilidad que tienen los átomos.
- La formación de los enlaces químicos con base en los electrones de Valencia.
Seguro has observado los colores de los fuegos artificiales o pirotecnia, pues bien, con él modelo de Bohr puedes explicar el porqué de los colores.
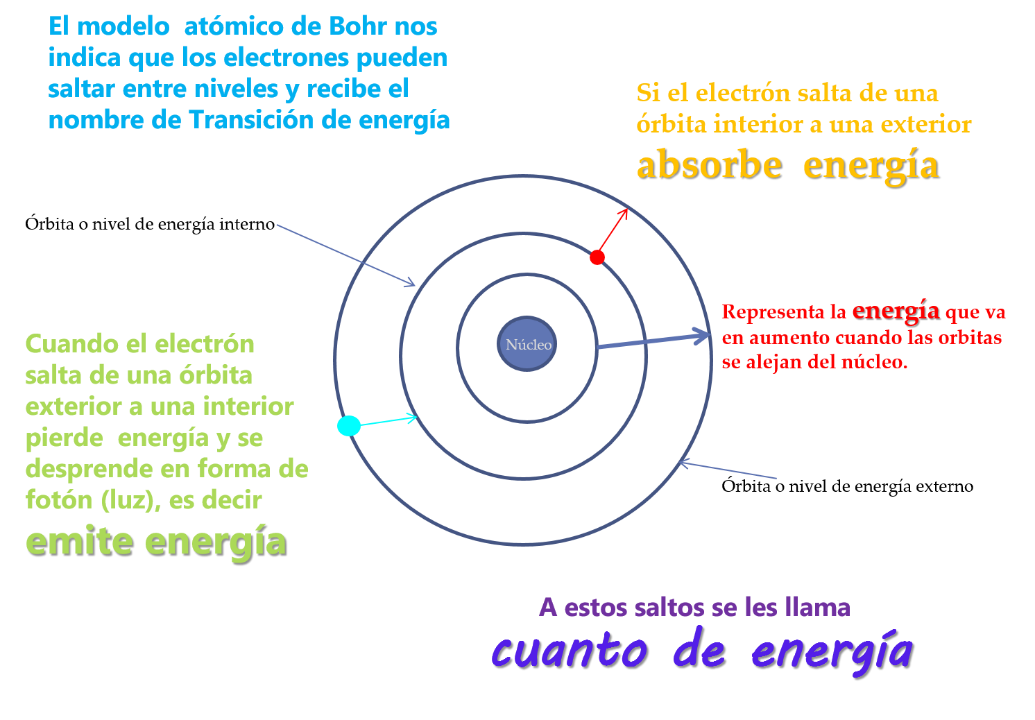
Recuerda que en las imágenes anteriores se menciona los saltos de electrones “Cuantos de energía”, resulta que cuando los metales o sus compuestos llamadas sales se calientan a temperaturas elevadas, los electrones de los átomos absorben energía y brincan a un nivel u órbita externa, pero su tendencia a recuperar con rapidez su estado fundamental los lleva a regresar a su órbita o nivel de energía, que es un nivel interior y por lo tanto emiten energía en forma de luz.
De esta manera un elemento da lugar a una serie de radiación que percibes con diferentes colores, por ejemplo, el color verde es por presencia de bario, el azul verdoso por cobre, el violeta por el potasio y el amarillo por el sodio.
Observa las siguientes cápsulas de información del minuto 02:05 a 02:53.
- ¿Cómo se forman las moléculas?
https://youtu.be/TTwMSfRmkd8
La siguiente obsérvala del minuto 03:08 a 03:26. - Átomos estables
https://youtu.be/0wIpIfsuu7E
Los electrones externos también llamados electrones de valencia son los responsables de las interacciones entre los átomos, es decir, participan en la unión de los átomos.
Son importantes en la formación de moléculas elementales, y de manera general en la producción de compuestos ya que determinan la capacidad del átomo para formar enlaces o uniones.
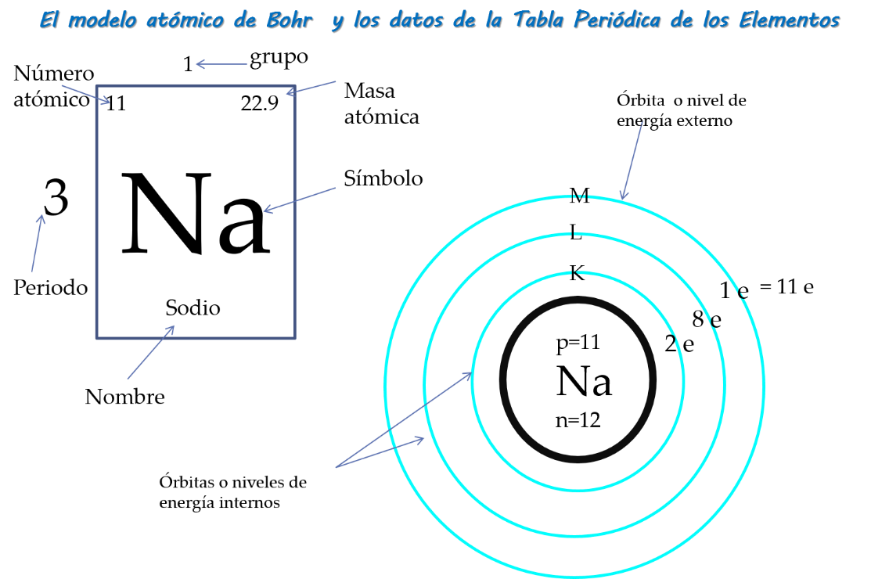
Observa la siguiente imagen, que brinda información sobre los electrones de valencia y sobre cómo se acomodan los electrones en las órbitas o los niveles de energía. Recuerda que la información de la tabla periódica permite predecir la estructura atómica. Analiza los siguientes ejemplos: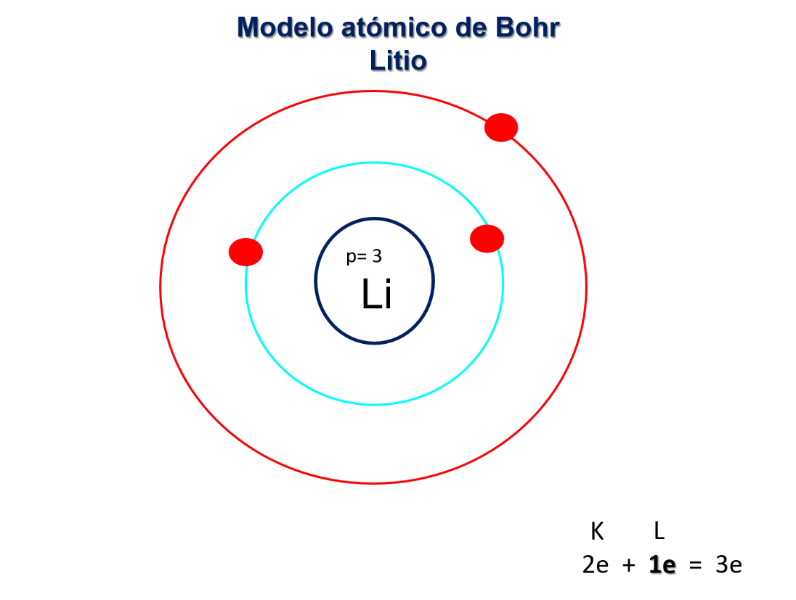
Si el átomo del elemento Litio se encuentra en el periodo 2 quiere decir que éste tiene 2 niveles de energía K y L. El Litio tiene el número atómico 3, por lo tanto, hay 3 protones en el núcleo y 3 electrones girando en esas dos órbitas. En el nivel K encontramos 2 electrones y en el L 1 electrón éste último será el electrón de valencia.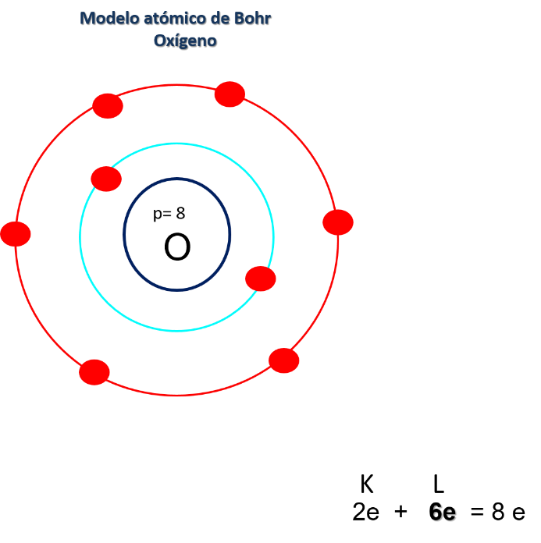
Otro ejemplo es el Oxígeno se encuentra en el periodo 2 con un número atómico 8. Dibuja el núcleo con 8 protones, dos niveles de energía, la órbita más cercana al núcleo es K con 2 electrones y le sigue L con 6 electrones. Siendo éstos los más alejados y por lo tanto son sus electrones de valencia.
Elabora un cuadro sinóptico sobre las características del modelo atómico de Bohr y los electrones de valencia y contesta el siguiente diagrama, siguiendo el orden que se te pide.
La importancia del modelo atómico de Bohr fue que con base en su propuesta evolucionó el estudio del átomo, ya que tenía muchas limitantes y ellas fueron el punto de partida de la Mecánica Cuántica.
En teoría Bohr explicó el comportamiento de un electrón del átomo de Hidrógeno, en una órbita circular fija.
Observa el siguiente video del minuto 03:41 a 05:04 y comenta con tu familia la importancia del estudio del átomo y del modelo atómico de Bohr. - El átomo
Reflexiona sobre el valor de la ciencia para la comprensión de fenómenos naturales.
- ¿Cuál es la importancia de los modelos en el conocimiento científico?
- ¿Cuál es la función de los electrones de valencia?
La ciencia tiene como fundamento la observación y la experimentación para explicar hechos naturales, a partir de métodos, modelos y teorías que van generando nuevos conocimientos, lo que contribuye para que logres entender de manera sencilla los sucesos que vives día a día.
Utilizar el modelo atómico de Bohr te ayuda a entender como está constituido el átomo y también a explicar la función de los electrones externos o de valencia, los cuales se mueven en órbitas estables en torno al núcleo.
El que sea posible representar al átomo y todo aquello que no es perceptible a simple vista es un aspecto de suma importancia de los modelos científicos como el modelo corpuscular y el modelo de Bohr.
El reto de hoy:
Si quieres saber más sobre el tema observa el video ¿por qué los fuegos artificiales son de colores?
Te sugerimos también, leer el artículo de la revista de divulgación científica de la UNAM. La receta cósmica de Alberto Güijosa:
http://www.comoves.unam.mx/numeros/articulo/129/la-receta-cosmica
¡Buen trabajo!
Gracias por tu esfuerzo.
Para saber más:


Login to join the discussion