¿Cómo reconocer los átomos de los elementos químicos?
Valoración de la comunidad:
Última Actualización:
6 de Febrero de 2025 a las 17:12Aprendizaje esperado : identifica que los átomos de los diferentes elementos se caracterizan por el número de protones que los forman.
Énfasis: reconocer que la identidad de los átomos de los elementos químicos se debe al número de protones en su núcleo y explicar la diferencia con la masa atómica; asimismo, identificar que los elementos tienen un espectro electromagnético específico.
¿Qué vamos a aprender?
Lee la siguiente frase de Hipatia de Alejandría, mujer y filosofa extraordinaria.
“Conserva celosamente tu derecho a reflexionar, porque incluso el hecho de pensar erróneamente es mejor que no pensar en absoluto”.
Los materiales que utilizarás son tu libro de texto de Ciencias Química, tu cuaderno de notas, tabla periódica, bolígrafos, lápices y colores.
NOTA para el docente. Se te recomienda la siguiente página de la UNAM llamada “Fábrica de átomos”, en donde tus alumnas y alumnos podrán construir átomos de diferentes elementos de la tabla periódica.
http://www.objetos.unam.mx/quimica/fabricaAtomos/index.html
¿Qué hacemos?
¿Sabes qué son las huellas dactilares?
Las huellas dactilares son una característica individual que se utiliza como medio de identificación de las personas ya que son únicas e irrepetibles de persona a persona.
Así como las huellas dactilares ayudan a identificar a las personas, algo similar ocurre con los átomos, sólo que en los átomos no son precisamente huellas dactilares.
Observa que el átomo está constituido por protones y neutrones que se encuentran en su núcleo, mientras que los electrones están distribuidos en órbitas con base en el modelo de Bohr.
La forma en la que es posible identificar a cada uno de los átomos de los elementos en la tabla periódica es por el número atómico, el cual está relacionado con el número de protones que éste contenga en su núcleo.
Observa el siguiente fragmento del video, del minuto 06:29 a 07:10.
-
¿Qué regularidades identifico en la tabla periódica?
Pudiste observar la organización de los elementos químicos en la tabla periódica.
Recupera y reflexiona, ¿cómo sabes cuál es el número atómico de los elementos químicos?
¿En el universo existen los mismos elementos químicos que conoces en la Tierra? ¿Serán diferentes? ¿Por qué?
Anota las respuestas en tu cuaderno y compleméntalas o corrige durante la sesión.
¿Sabías qué? Uno de los elementos que aparece en la tabla periódica fue descubierto en el espacio. ¿Adivina cuál es? Se trata del helio (He), que se observó por primera vez como una línea amarilla brillante en un espectro de la luz del Sol.
Este descubrimiento se dio en 1868, casi tres décadas antes de ser descubierto en la Tierra. Por si fuera poco, en 2018 un equipo de científicos encontró por primera vez helio en la atmósfera de un exoplaneta.
Recuerda que el número atómico indica el número de protones en el núcleo del átomo de un elemento químico dado. Un átomo es eléctricamente neutro cuando el número de protones es igual al número de electrones. Por lo tanto, el número atómico, también será igual al número de electrones presentes en el átomo.
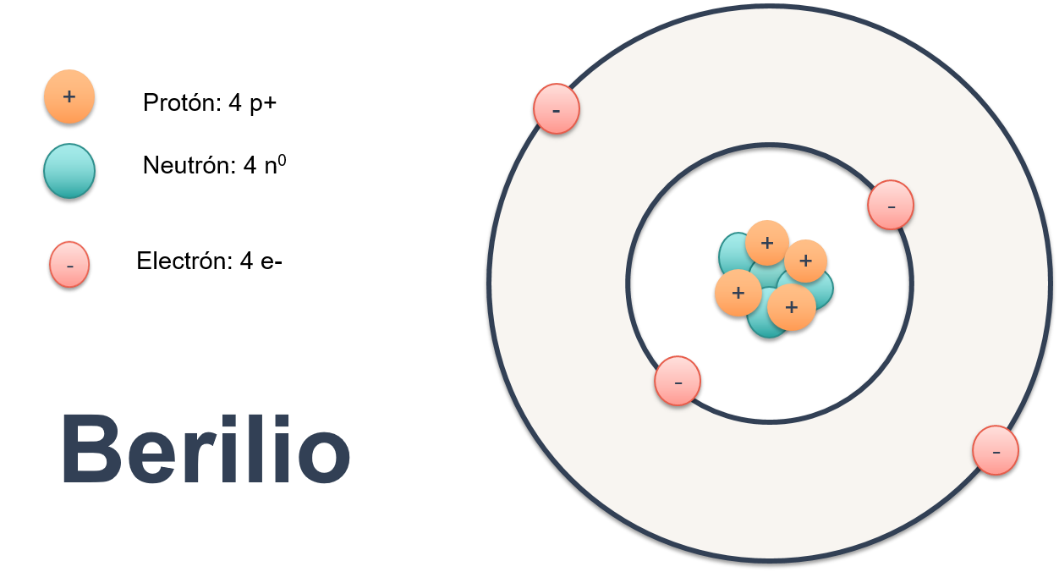
En la imagen puedes observar que el berilio, representado mediante el modelo de Bohr, tiene 4 protones, 4 neutrones y 4 electrones, por lo que se encuentra eléctricamente neutro, ya que el número de protones y electrones es el mismo.
El número atómico se tomó en cuenta para ordenar a los elementos en la tabla periódica y se representa con la letra Z.
Todos los átomos tienen una estructura común, tienen un núcleo que está formado por protones y neutrones, así como electrones que se cree que se mueven alrededor de él.
Los protones tienen carga eléctrica positiva y los electrones tienen carga eléctrica negativa, lo que hace que el átomo sea eléctricamente neutro.
Cada elemento químico está formado por átomos del mismo tipo, es decir, los átomos de un mismo elemento químico tienen el mismo número de protones. Es importante que recuerdes que los átomos en la naturaleza por lo general no se encuentran aislados o solos, sino que comúnmente forman enlaces químicos.
Si revisas la tabla periódica de elementos químicos, te darás cuenta de que dentro de los periodos están ordenados de forma creciente de izquierda a derecha con base en su número atómico.
El núcleo es la región más densa del átomo, se ubica en el centro y en éste se encuentran los protones y los neutrones; esta zona concentra casi el total de la masa, por ello el número de neutrones y protones determina el número de masa que se representa con la letra A. Este valor es siempre un número entero.
Protones + neutrones = número de masa.
Por ejemplo, el uranio tiene un número de masa (A) = 238 y su número atómico (Z) es 92, por lo que el número de neutrones en su núcleo será A – Z = n0, es decir, n0= 238 – 92 = 146, por lo que en el núcleo hay 146 neutrones.
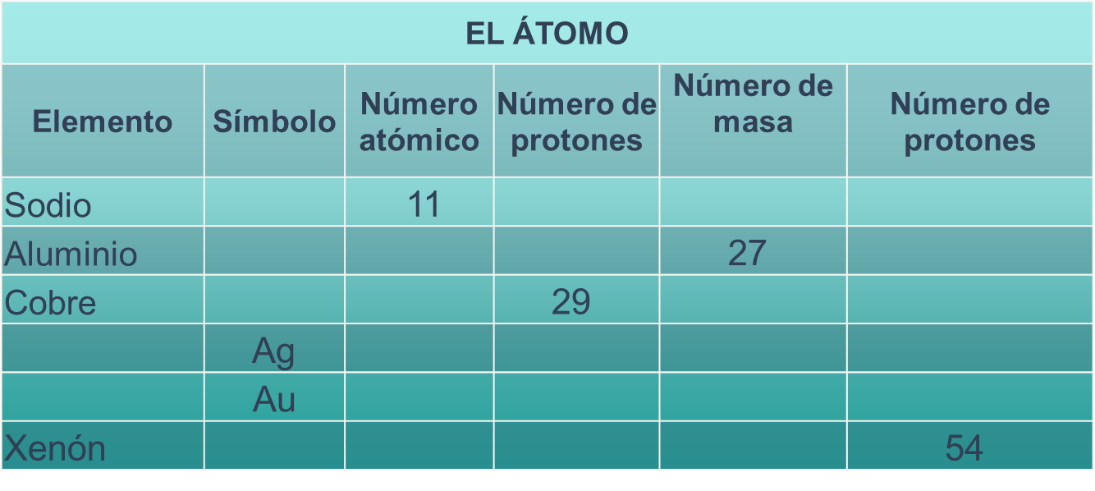
Después de analizar este ejemplo, realiza la actividad relacionada con el número atómico completando la siguiente tabla, apóyate en la tabla periódica.
En el desarrollo de la tabla periódica han participado desde mujeres reconocidas como Marie Curie, hasta mujeres cuya aportación a la ciencia no ha sido lo suficientemente divulgada, una de ellas es Irene Joliot-Curie, hija de la tan conocida química.
Otras mujeres cuya labor ha sido crucial para que la tabla periódica sea tal y como es actualmente, han sido Harriet Brooks, Ida Tacke-Noddack, Marguerite Perey y Lise Meitner. Entre otras aportaciones, gracias a ellas se descubrieron elementos como el francio y el renio y contribuyeron a entender las fisiones nucleares.
Se ha mencionado que la suma de los neutrones y los protones da como resultado el número de masa. Existen átomos del mismo elemento que pueden tener diferente número de neutrones e igual número de protones, éstos son llamados isótopos.
Dicho de otra manera, se les llaman isotopos a los átomos con el mismo número atómico pero que difieren en su número de masa debido a que tienen el mismo número de protones, pero diferente de neutrones.
En ocasiones se suele confundir el número de masa y la masa atómica, pero debes recordar que el número de masa, es la suma de los protones y los neutrones de un átomo y las masas atómicas reportadas en la tabla periódica son masas atómicas promedio calculadas con las masas de sus diferentes isótopos y su abundancia relativa en la Tierra; por esta razón su valor se expresa con un número entero y decimales.
Para calcular el valor de la masa atómica de un elemento se toman en cuenta todos los isótopos y la abundancia relativa o porcentaje ponderado de cada uno de ellos para obtener la masa promedio del elemento, por ello las masas atómicas no son exactas.
¿Recuerdas a Protio, Deuterio y Tritio? Ellos son unos isótopos del hidrógeno, ubica en tu tabla periódica el elemento químico hidrógeno.
Con base en lo antes explicado, su número atómico es 1, entonces es el primer elemento de la tabla periódica.
El hidrógeno es el elemento más ligero que existe, su átomo está formado por un protón y un electrón y en la naturaleza generalmente se encuentra formando una molécula diatómica.
En el universo, las estrellas y los planetas tienen composición diferente. El elemento más abundante es el hidrógeno.
Los isótopos, tienen el mismo número de protones, sin embargo, tienen diferente composición.
Esto se debe al número de neutrones que cada uno tiene.
Por ejemplo, Protio tiene composición de un protón cuando es eléctricamente neutro, también tiene un electrón, pero no tiene neutrón, por lo que su número de masa es A= 1, es estable y su abundancia es del 99.99% en la Tierra.
Deuterio tiene por composición un protón, y un neutrón, su número de masa es A= 2, eléctricamente neutro, en consecuencia, un electrón, es estable y su abundancia en la Tierra es de 0.01%
Tritio es el más pesado, tiene una composición de un protón, un electrón, y dos neutrones. Su número de masa es A= 3, es radioactivo y su abundancia en la Tierra es de 0.000001%.
En el caso del carbono, un átomo eléctricamente neutro, tiene 6 protones y 6 electrones, pero podría tener 6, 7 u 8 neutrones; así, se tendrían átomos diferentes de carbono, a los cuales se les denomina isótopos del carbono, y se les denota como 12C, 13C y 14C respectivamente.
En otro ejemplo, el del plomo elemental (Pb) puedes observar que tiene cuatro isótopos naturales, cuyas masas atómicas (u) y abundancia, son los valores que se observan en la siguiente imagen.
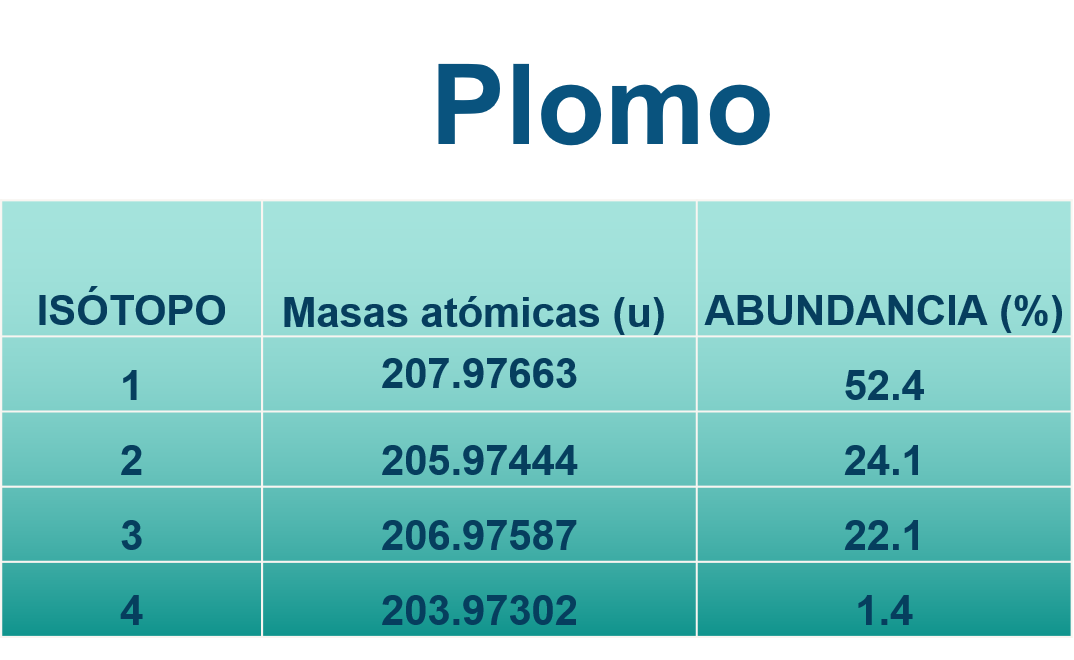
Para obtener su masa atómica promedio tendrías que multiplicar la masa atómica (u) de cada isótopo por la abundancia que presenta y hacer la suma de estas 4 multiplicaciones, después dividir entre 4 para sacar el promedio.
¿Cuál sería entonces la masa atómica promedio del plomo?
¿El dato que obtuviste coincide con el reportado en la tabla periódica?, ¿por qué?
Existen dos tipos principales de isótopos: los radiactivos y los estables. Ambos tipos se usan ampliamente en diferentes industrias y campos de estudio. Por ejemplo, los isótopos de cobalto se usan en medicina nuclear para detener la propagación del cáncer.
Los isótopos radiactivos pueden usarse como trazadores en pacientes para monitorear varios procesos internos.
En la industria, estos elementos pueden medir el grosor de un metal.
Los isótopos inestables de uranio se utilizan como combustible de las centrales nucleares.
Para la construcción de armamento nuclear como la bomba atómica se utilizan isótopos de uranio , plutonio y de hidrógeno.
Investiga más sobre los elementos radioactivos, y los isótopos radioactivos.
Al inicio de la sesión se mencionó que las huellas dactilares son una característica individual que se utiliza como medio de identificación de las personas, lo mismo ocurre con los elementos, tienen sus espectros de emisión y de absorción. Así es como también puedes diferenciar un elemento de otro.
El conjunto de líneas espectrales que se obtiene para un elemento específico es siempre el mismo, cada elemento produce su propio espectro diferente al de cualquier otro elemento. Esto significa que cada elemento tiene su propia firma espectral.
Los rayos “X”, las ondas de radio, los rayos ultravioleta, los rayos gama y las microondas.
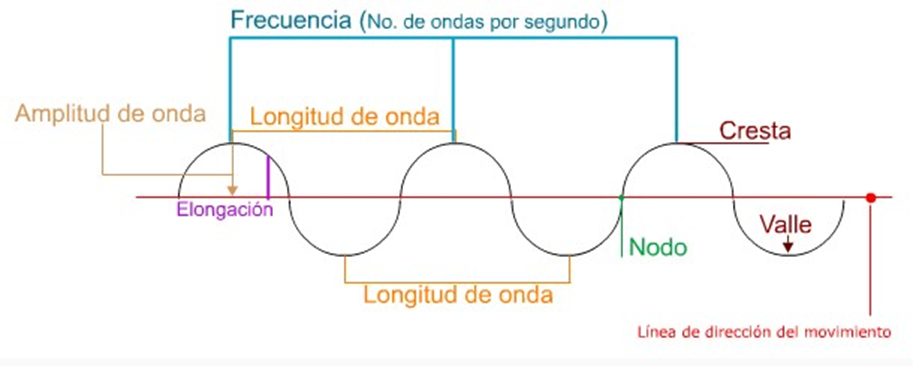
Las ondas electromagnéticas consisten en un campo eléctrico y otro magnético de forma perpendicular entre sí. La única diferencia entre los tipos de radiación electromagnética es su longitud de onda o su frecuencia.
Las propiedades de las ondas son la longitud, la amplitud y la frecuencia. Revisa la siguiente dirección electrónica para que indagues más acerca de los espectros de emisión y absorción de cada uno de los elementos de la tabla periódica.
http://www.educaplus.org/luz/espectros.html
Si te es posible observa el programa de Aprende en casa, porque se le realizará una entrevista a la doctora Fabiola Monroy Guzmán, egresada de la Facultad de Química de la UNAM, quien actualmente labora en el Instituto Nacional de Investigaciones Nucleares en el Estado de México.
Las preguntas que se le realizarán son:
1. Doctora Fabiola, por su labor científica y su estado laboral actual, comprendemos que usted dedica su tiempo de investigación a la energía nuclear. En términos sencillos, ¿cuándo se considera que un átomo es radiactivo?, ¿existen elementos radiactivos en la naturaleza?
2. Doctora Fabiola, nos podría explicar, ¿es posible producir elementos radiactivos?, y si es así, ¿qué métodos se utilizan para producirlos?
3. En particular ¿qué beneficios o daños pueden causar?
4. Doctora Fabiola, con respecto a los radioisótopos, ¿qué aplicaciones tienen en la vida cotidiana?
5. ¿Cómo se aplican los radioisótopos en la medicina?
En esta sesión aprendiste sobre la estructura de los átomos de los elementos químicos, con base en el modelo de Bohr.
Asimismo, que el número atómico se toma como base para organizar a los elementos en la tabla periódica.
También aprendiste las diferencias entre el número de masa y masa atómica, ya que el valor del primero depende de la suma de los protones y neutrones, y el valor del segundo del promedio de las masas atómicas de cada isótopo en relación con su abundancia en la Tierra.
Asimismo, comprendiste la composición de los isótopos y su aplicación en la vida cotidiana.
El reto de hoy:
Revisa la siguiente página donde podrás ampliar tus conocimientos en el tema de átomos y partículas subatómicas.
https://www.aev.dfie.ipn.mx/Materia_quimica/temas/tema2/subtema3/subtema3.html 

Visita también la siguiente liga, en donde encontrarás una tabla periódica interactiva con información de cada elemento.
http://objetos.unam.mx/quimica/tablaPeriodica/index.html
¡Buen trabajo!
Gracias por tu esfuerzo.




Login to join the discussion